
| A.冬天,块状的锌与2mol/L稀硫酸溶液反应 |
| B.冬天,粉末状的锌与2mol/L稀硫酸溶液反应 |
| C.夏天,块状的锌与2mol/L稀硫酸溶液反应 |
| D.夏天,粉末状的锌与2mol/L稀硫酸溶液反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 pC(g) △H 在密闭容器器中进行,如图所示,反应在不同时间t、温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g) △H 在密闭容器器中进行,如图所示,反应在不同时间t、温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是 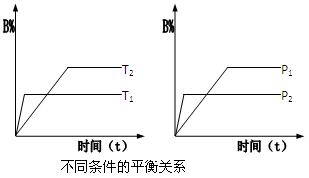
| A.T1<T2,p1>p2,m+n>p,△H>0 |
| B.T1>T2,p1<p2,m+n>p,△H>0 |
| C.T1>T2,p1<p2,m+n<p,△H<0 |
| D.T1>T2,p1>p2,m+n>p,△H<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示。请回答下列问题:
2SO3(g)(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示。请回答下列问题: (1)0~4 min的平均反应速率v(SO2)= mol·l-1·min-1
(1)0~4 min的平均反应速率v(SO2)= mol·l-1·min-1
| 改变的条件 | V正 | V逆 |
| ①增大O2的浓度 | 增大 | |
| ②减小SO3的浓度 | | 减小 |
| ③缩小容器的体积 | 增大 | |
| ④加入V2O5作催化剂 | 增大 | |
| ⑤压强不变充入He气体 | | 减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是| A.混合气体的压强不变 | B.消耗2molB的同时生成1molC | C.混合气体的相对分子质量不变 | D.气体的总物质的量不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.凡是能量达到活化能的分子发生的碰撞均为有效碰撞。 |
| B.增大反应物浓度能加快正反应的反应速率,降低逆反应的反应速率 |
| C.温度升高使化学反应速率加快的主要原因是增加了反应物分子之间的碰撞次数 |
| D.决定化学反应速率的根本因素是参加反应的各物质的性质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验 序号 | 反应温 度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 40 | 5 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 0 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com