
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L0.1molL﹣1CH3COOH溶液中加入0.1molCH3COONa固体,平衡后则溶液中![]() ___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
(2)常温下向20mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
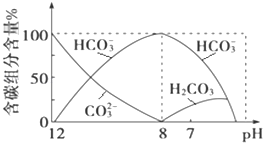
回答下列问题:
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣___(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有_____、___,溶液中含量最多的三种微粒的物质的量浓度的大小关系为____;
③已知在25℃时,CO32﹣水解反应的平衡常数即水解常数Kh═2×10﹣4 molL﹣1,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,溶液的pH=_____。
【答案】不变 c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+) 不能 HCO3﹣ H2CO3 c(Na+)>c(Cl﹣)>c(HCO3﹣) 10
【解析】
(1)Ka=![]() 只与温度有关;溶液中存在电荷守恒;
只与温度有关;溶液中存在电荷守恒;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水;
①根据图像可知,pH=8时溶液中主要为碳酸氢根离子,pH大于8时存在碳酸根离子和碳酸氢根离子离子,pH小于8时存在碳酸和碳酸氢根离子,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存;
②根据图像pH=7时,溶液中存在的离子主要为:H2CO3、HCO3-,溶液显示中性,c(H+)=c(OH-),此时加入盐酸的体积大于20mL小于40mL,溶液中溶质为碳酸氢钠、氯化钠及碳酸,由此判断溶液中主要微粒浓度大小关系;
③水解常数Kh=![]() ,当溶c(HCO3-):c(CO32-)=2:1时,根据水解常数计算c(OH-),由水的离子积Kw计算c(H+),根据pH=-lgc(H+)计算。
,当溶c(HCO3-):c(CO32-)=2:1时,根据水解常数计算c(OH-),由水的离子积Kw计算c(H+),根据pH=-lgc(H+)计算。
(1)一定温度下,向1L 0.1molL﹣1CH3COOH溶液中加入0.1mol CH3COONa固体,由于温度不变,Ka=![]() 只与温度有关,所以
只与温度有关,所以![]() 不变;溶液中存在电荷守恒为:c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+);
不变;溶液中存在电荷守恒为:c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+);
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成碳酸(部分碳酸分解成二氧化碳)、水;
①由反应及图象可知,在同一溶液中,H2CO3、HCO3﹣、CO32﹣不能大量共存;
②由图象可知,pH=7时,溶液中含碳元素的主要微粒为HCO3﹣、H2CO3,溶液显示中性,溶液中c(H+)=c(OH-),此时加入盐酸的体积大于20mL小于40mL,发生的反应有Na2CO3+HCl=NaHCO3+NaCl(Na2CO3完全反应)、NaHCO3+HCl=NaCl+H2CO3(NaHCO3部分反应),溶液中溶质为碳酸氢钠、氯化钠(NaCl浓度大于碳酸氢钠浓度)及碳酸,则溶液中含量最多的三种微粒的物质的量浓度的大小关系为c(Na+)>c(Cl﹣)>c(HCO3﹣);
③CO32﹣的水解常数Kh=![]() =2×10﹣4,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,c(OH﹣)=10﹣4mol/L,由Kw可知,c(H+)=10﹣10mol/L,所以pH=10。
=2×10﹣4,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,c(OH﹣)=10﹣4mol/L,由Kw可知,c(H+)=10﹣10mol/L,所以pH=10。


科目:高中化学 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
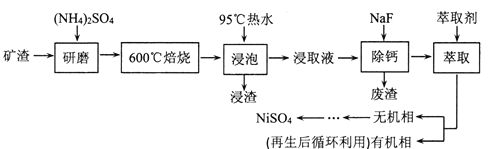
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
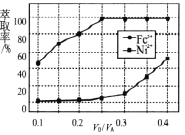
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。
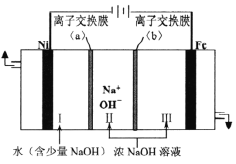
①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )
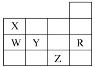
A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)乙醇分子中C原子的杂化方式是_________
(4)[Cu(NH3)4]2+中,提供孤对电子的是________,Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是_______(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是_________。
(5)硫元素对应的含氧酸酸性是H2SO4
强于H2SO3,其原因为___________________。
(6)铜的一种氧化物晶体结构如图所示,
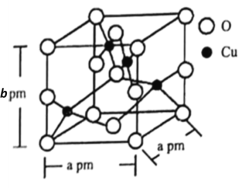
该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、Kb、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、弱碱的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是______。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=____。
(3)高炉炼铁中发生的反应有FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
(4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是______(已知lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,D单质是一种淡黄色固体。请回答:
①C2B2的电子式是___________,D、E可形成化合物DE2中,存在下列哪些静电作用力______。
a.极性键 b.非极性键 c.范德华力 d.氢键 e.离子键
②B、C、E的离子半径由大到小的顺序为_______________(用化学式回答),举一个事实证明E和D非金属性的强弱___________________(用离子反应方程式表示)。
(2)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:

当尿素三聚时,得到两种产物,其中一种为环状结构,请画出其结构式___________。
(3)已知某元素的原子序数是33,试推测该元素:
①原子的原子结构示意图______________。
②在元素周期表中的位置______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素的第一电离能:Al____Si(填“>”或“<”),按电负性由大到小的顺序排列N、O、F___。
(2)基态Mn2+的核外电子排布式为___。
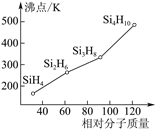
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是___。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
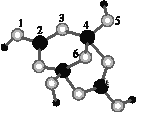
①在Xm-中,硼原子轨道的杂化类型有___;配位键存在于___原子之间(填原子的数字标号)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有___(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力E.氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技创新的产品设备在工作时有化学能转变成电能的是( )
A. [Failed to download image : http://192.168.0.10:8086/QBM/2019/6/24/2232583815659520/2233878409273344/STEM/470d05a5dd2448b794aa06c917ec6f19.png]长征5号火箭使用的液氧煤油发动机
B.  北斗导航卫星的太阳能电池板
北斗导航卫星的太阳能电池板
C.  位于江苏的海上风力发电厂
位于江苏的海上风力发电厂
D.  世界首部可折叠柔屏手机
世界首部可折叠柔屏手机
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①乙酸 ②苯酚 ③碳酸 ④乙醇
I.甲同学设计并实施了如下实验方案。
编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①③溶液 | 略 |
2 | 将CO2通入C6H5ONa溶液中 | 方程式:______________。 | |
3 | 配制等物质的量浓度的CH3COONa、 NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于 CH3COONa溶液 | 略 |
4 | 向含酚酞的NaOH溶液中,各滴加等量的②④两种溶液 | ④中无明显现象 ②中红色明显变浅 | 滴加②时方程式:______。 |
结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)______________。 | |||
II.乙同学对甲同学的实验提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)D中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有________溶液的洗气装置,使乙同学的实验设计更加完善。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com