
| A. | 2~3之间 | B. | 3~4之间 | C. | 4~5之间 | D. | 5~6之间 |
分析 任何电解质溶液中都存在电荷守恒,根据电荷守恒计算酸雨中氢离子浓度,再根据pH计算公式计算溶液pH,据此分析解答.
解答 解:根据电荷守恒得2c(SO42-)+c(Cl-)+c(NO3-)=c(NH4+)+c(Na+)+c(H+),
则2.8×10-5mol•L-1×2+6.0×10-6mol•L-1+2.3×10-5mol•L-1=2.0×10-6mol•L-1 +3.0×10-6mol•L-1+c(H+),则c(H+)=8.0×10-5mol•L-1,则溶液的pH=-lgc(H+)=-lg8.0×10-5≈4.1,
故选C.
点评 本题考查了pH简单计算,正确计算溶液中氢离子浓度是解本题关键,注意守恒思想的运用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
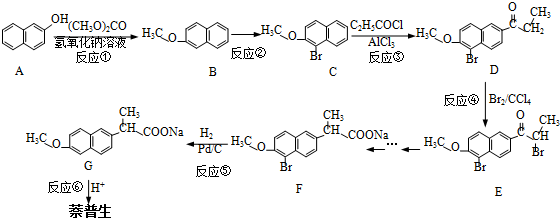
 )的化学性质与苯相似.
)的化学性质与苯相似. )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是 .
. (任写一种).
(任写一种). 的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | HCN | H2CO3 |
| 电离平衡常数(25℃) | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | Na2CO3溶液中滴入等体积、等浓度的盐酸后,溶液中一定存在:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-) | |
| B. | Na2CO3溶液中通一定量的CO2气体后,溶液中一定存在:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | Na2CO3溶液加水稀释后,c(H+)增大 | |
| D. | Na2CO3溶液中加入过量HCN,反应方程式为:Na2CO3+HCN=NaHCO3+NaCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作供氧剂 | |
| B. | 硅胶多孔,吸水能力强,常用作袋装食品的干燥剂 | |
| C. | SO2具有漂白性,常用药食品的漂白 | |
| D. | K2FeO4可用于水的净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CH3COOH均为共价化合物 | |
| B. | 每生成1molCH3COOH,要消耗22.4LCO2 | |
| C. | CO2、CH3COOH分子中均含σ键和π键 | |
| D. | CH4$→_{-H_{2}}^{催化剂}$CHX属于氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
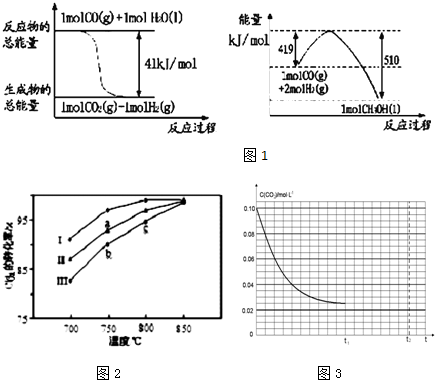
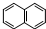
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
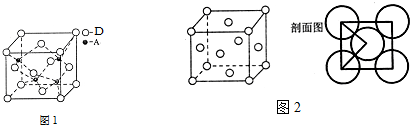
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:5 | D. | 6:7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com