
利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________。
科目:高中化学 来源: 题型:
判断下列热化学方程式书写是否正确,正确的划“√”,错误的划“×”(注:焓变数据均正确)
(1)CaCO3(s)===CaO+CO2(g) ΔH=+177.7 kJ( )
(2)C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
(3)C(s)+ O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1( )
(4)CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1( )
(5)2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1( )
(6)500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热
19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1( )
2NH3(g) ΔH=-38.6 kJ·mol-1( )
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_______________________________________。
(2)已知:CH3OH(g)+ O2(g)??CO2(g)+2H2(g)
O2(g)??CO2(g)+2H2(g)
ΔH1=-192.9 kJ·mol-1
H2(g)+ O2(g)??H2O(g)
O2(g)??H2O(g)
ΔH2=-120.9 kJ·mol-1
则甲醇与水蒸气催化重整反应的焓变ΔH3=__________________。
(3)苯乙烯是重要的基础有机原料。工业中用乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH===CH2)的反应方程式为
C6H5—CH2CH3(g)??C6H5—CH===CH2(g)+H2(g) ΔH1
已知:3C2H2(g)??C6H6(g) ΔH2
C6H6(g)+C2H4(g)??C6H5—CH2CH3(g) ΔH3
则反应3C2H2(g)+C2H4(g)??C6H5—CH===CH2(g)+H2(g)的ΔH=____________。
(4)氨的合成是最重要的化工生产之一。
工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)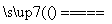 CO(g)+H2(g);
CO(g)+H2(g);
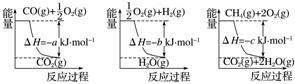
②用天然气跟水蒸气反应:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知有关反应的能量变化如下图所示,则方法②中反应的ΔH=____________。
(5)甲醇是一种用途广泛的化工原料。
工业上常用下列两种反应制备甲醇:
①CO(g)+2H2(g)??CH3OH(g)
ΔH1=-90.1 kJ·mol-1
②CO2(g)+3H2(g)??CH3OH(g)+H2O(l) ΔH2
已知:CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH3=-41.1 kJ·mol-1
H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1
则ΔH2=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X,为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_____________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用__________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO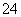 )为________ mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________ mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________。制备X的化学方程式为___________________;
X的制备过程中温度不能过高的原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.常温下,某溶液中由水电离出的c(H+)=1×10-amol·L-1,若a>7时,则该溶液的pH一定为14-a
B.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液,两溶液中水的电离程度相同
C.温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变
D.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分被氧化的钠样品10 g,将其投入水中充分反应,将所得溶液稀释成400 mL,若实验测得该钠样品中含有8%的氧元素,则常温下所得溶液的pH为( )
A.14 B.13
C.12 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期数等于原子核外电子层数
C.最外层电子数为8的都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③ B.③④⑤⑥
C.①③⑤ D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com