
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH1=-1 274.0 kJ/mol
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)===H2O(l) ΔH3=-44 kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________________________。
(2)生产甲醇的原料CO和H2可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
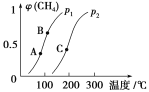
①一定条件下CH4的平衡转化率与温度、压强的关系如图。则p1________p2(填“<”、“>”或“=”)。A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为________________。
②100 ℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是________(填序号)。
a.容器的压强恒定
b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2)
d.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示,通入a气体的电极是原电池的________极(填“正”或“负”),其电极反应式为______________________________。

【答案】(1)CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442 kJ/mol
(2)①< KA<KB<KC ②ac (3)负 CH3OH-6e-+H2O===CO2↑+6H+
【解析】(1)依据盖斯定律,由(①-②+4×③)÷2得:CH3OH(l) +O2(g)===CO(g)+2H2O(l) ΔH=-442 kJ/mol。(2)①由图可知温度相同,压强为p1时CH4的转化率高于压强为p2时CH4的转化率,该反应为气体分子数增大的反应,减小压强平衡正向移动,则p1<p2。该反应为吸热反应,升高温度平衡右移,平衡常数增大,故KA<KB<KC。②a项,该反应为反应前后气体分子数不相等的反应,容器的压强恒定说明反应达到平衡状态;b项,由于容器体积不变且反应前后气体总质量不变,故容器内气体密度为一定值,b项不能说明反应达到平衡状态;c项说明正逆反应速率相等,反应达到平衡状态;d项描述的是同一反应方向上CH4和H2的物质的量的变化情况,任意时刻均成立,不能说明反应达到平衡状态。(3)根据H+和电子的移动方向知,通入a气体的电极为负极、通入b的电极为正极,图中交换膜是质子交换膜,则电解质溶液呈酸性,负极发生氧化反应,其电极反应式为CH3OH-6e-+H2O===CO2↑+6H+。


科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表所示:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列选项正确的是( )
A.2CN-+H2O+CO2===2HCN+CO![]()
B.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C.物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-)
D.c(NH![]() )相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A. 所有的非金属元素都在p区
B. 磷的外围电子排布方式为3s23p3
C. 碱金属元素具有较小的电负性
D. 当各轨道处于全满、半满、全空时原子较稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是
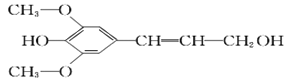
A. 芥子醇的分子式中有一种含氧官能团
B. 芥子醇分子中所有碳原子不可能在同一平面上
C. 芥子醇能与FeCl3溶液发生显色反应,且1mol芥子醇能够与3 mol的Br2水反应
D. 芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.过量的铜与浓硝酸反应有一氧化氮生成
B.Al、Fe、Cu的单质放置在空气中均只生成氧化物
C.SiO2与酸、碱均不反应
D.向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,则H2SiO3的酸性比H2CO3的酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热也是△H=-57.3kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g)。下列说法不正确的是
2SO3(g)。下列说法不正确的是
A. 改变反应条件可以改变该反应的限度
B. 达到平衡后,SO3、SO2、O2在密闭容器中共存
C. 达到平衡后,反应停止,正、逆反应速率都等于零
D. 增大压强,正逆反应速率均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com