
【题目】Ⅰ.25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。
(1)HA是_____(填“强电解质”或“弱电解质”,下同),BOH是____。
(2)HA的电离方程式是____、BOH的电离方程式是______。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_____(填字母)。
A.![]() B.
B.![]() C.c(H+)与c(OH-)的乘积 D.c(OH-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体____(填“多”、“少”或“相等”)。
Ⅱ. 在25 ℃时,请进行有关计算:(已知lg2=0.3)
(5)现有pH=2的HCl溶液100 mL,要使它的pH=3,如果加入蒸馏水,需加水___mL;如果加入pH=4的HCl溶液,需加入此HCl溶液____ mL(假定溶液体积有加和性,下同)。
(6)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH=____。
(7)将0.1 mol·L-1盐酸和0.06 mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=_____。
(8)pH=a的X体积的某强酸与pH=b的Y体积的某强碱混合后,溶液呈中性,已知a+b=15,则X:Y=_____。
【答案】弱电解质 强电解质 HAH++A BOH=B++OH- B 多 900 1 000 10.7 12 10∶1
【解析】
Ⅰ. (1)-(4)KW=C(H+)C(OH-)=10-14,KW是只与温度有关的常数,0.1mol/L 的HA溶液中c(H+)=10-10,溶液中HA中的氢离子未全部电离,说明HA为弱酸,0.01mol/L的BOH溶液pH=12,溶液中氢离子浓度=0.01mol/mol,说明BOH为强碱;
Ⅱ. (5)强酸加水稀释10n倍,PH增大n个单位;强酸与强酸混合,根据混合后溶液中氢离子物质的量相等,再求所加酸的体积;
(6)将pH=8的NaOH与pH=11的NaOH溶液等体积混合,先计算出混合液中氢氧根离子浓度,然后计算出氢离子浓度及溶液的pH;
(7)先求剩余的氢氧根的浓度,再求pH;
(8)强酸和强碱混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,根据物质的量相等计算。
(1)由分析可知,HA为弱酸为弱电解质,BOH是强碱属于强电解质,故答案为:弱电解质;强电解质;
(2)HA为弱酸存在电离平衡,电离方程式为:HAH++A-,BOH是强碱属于强电解质,电离方程式为:BOH=B++OH-;故答案为:HAH++A-;BOH=B++OH-;
(3)在加水稀释HA的过程中,促进HA电离平衡正向进行,平衡状态下的微粒浓度减小,溶液中存在离子积常数,温度不变,离子积常数不变,
A.加水稀释促进电离,加水稀释促进HA电离,n(H+)增大、n(HA)减小,溶液体积相同,所以![]() 比值增大,故A错误;
比值增大,故A错误;
B.加水稀释促进电离,加水稀释促进HA电离,n(A-)增大、n(HA)减小,溶液体积相同,所以![]() 比值减小,故B正确;
比值减小,故B正确;
C.温度不变,溶液中离子积常数不变,c(H+)与c(OH-)的乘积不变,故C错误;
D.加水稀释,溶液中氢离子浓度减小,c(H+)与c(OH-)的乘积不变,c(OH-)增大,故D错误;
故答案为:B;
(4)等pH的HA溶液和盐酸,HA是弱酸,盐酸是强酸,所以HA的物质的量浓度大于盐酸,等体积等pH的HA和盐酸,HA的物质的量大于盐酸,所以向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2是HA多,故答案为:多。
Ⅱ. (5)强酸加水稀释10n倍,PH增大n个单位,则现有pH=2的HCl溶液100mL,要使它的pH=3,则溶液的体积变为1000mL,所以要加入900ml蒸馏水;设加入入pH=4的HCl溶液V,n(H+)等量关系有:10-2×100×10-3+10-4V=10-3(V+100)×10-3,V=1L=1000mL;故答案为:900;1000;
(6)将pH=8的NaOH溶液中氢氧根离子浓度为:1×10-6mol/L,pH=11的NaOH溶液中氢氧根离子浓度为:1×10-3mol/L,两溶液等体积混合后溶液中氢氧根离子浓度为:![]() ≈5×10-4mol/L,混合液中氢离子浓度为:c(H+)=
≈5×10-4mol/L,混合液中氢离子浓度为:c(H+)=![]() =2×10-11mol/L,则混合液的pH═-lg[c(H+)]=11-lg2=9.7,故答案为:10.7;
=2×10-11mol/L,则混合液的pH═-lg[c(H+)]=11-lg2=9.7,故答案为:10.7;
(7)盐酸是一元强酸,氢氧化钡是二元强碱,将0.1mol/L盐酸和0.06mol/L氢氧化钡溶液等体积混合后,氢氧化钡有剩余,该混合溶液中氢氧根离子浓度=![]() =0.01mol/L,则氢离子浓度=
=0.01mol/L,则氢离子浓度=![]() =10-12 mol/L,所以混合溶液的pH=12,故答案为:12;
=10-12 mol/L,所以混合溶液的pH=12,故答案为:12;
(8)酸中氢离子浓度=10-a mol/L,碱中氧根离子浓度=10b-14 mol/L,则:10-a mol/L×X=10b-14 mol/L×Y,且a+b=15,解得X:Y=10:1,故答案为:10∶1。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
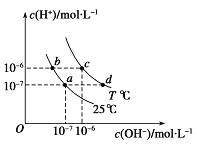
A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
B.T<25℃
C.b点和c点pH均为6,溶液呈酸性
D.只采用升温的方式,可由a点变成d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示.下列说法正确的是
与pH的关系如图所示.下列说法正确的是![]()

A.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
B.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
C.往该溶液中逐滴滴加氢氧化钠时![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.通过分析可知常温下![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知过氧化氢在强碱性溶液中主要以HO2-存在。我国研究的Al-H2O2燃料电池可用于深海资源的勘查、军事侦察等国防科技领域,装置示意图如下。下列说法错误的是

A. 电池工作时,溶液中OH-通过阴离子交换膜向Al极迁移
B. Ni极的电极反应式是HO2-+2e-+H2O=3OH-
C. 电池工作结束后,电解质溶液的pH降低
D. Al电极质量减轻13.5g,电路中通过9.03×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)![]() CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A. 单位时间内消耗2 mol的CO同时生成2 mol的CO2
B. 两个H—O键断裂的同时有一个H—H键断裂
C. 反应容器内的压强不再发生变化
D. 混合气体的相对分子质量不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
②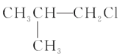 ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中![]() 下列分析正确的是
下列分析正确的是![]()
![]()

A. ![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B. ![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C. ![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. ![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
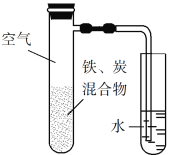
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com