
【题目】某兴趣小组进行下列实验:
①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是( )
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH![]() 可能是④中沉淀溶解的原因
可能是④中沉淀溶解的原因
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在容积为![]() 的密闭容器内,物质D在
的密闭容器内,物质D在![]() 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
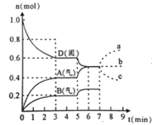
A.从反应开始到第一次达到平衡时,B物质的平均反应速率为![]()
B.该反应的化学方程式为![]() ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为![]()
C.已知:反应的![]() ,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D.若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是b曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)请用双线桥法对该反应进行标注_________________________________。
(2)写出该反应的离子方程式________________。
(3)该同学用43.5g MnO2与足量的 HCl(浓)反应,可制备标况下的氯气的体积为_______ L,反应中转移的电子的物质的量为_______mol,反应中被氧化的HCl物质的量为_______mol。
(4)在实验室中,欲用如图中的装置净化氯气,则瓶①②中应盛放的试剂分别是①____,②_____(填试剂名称)。
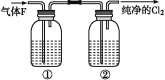
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )
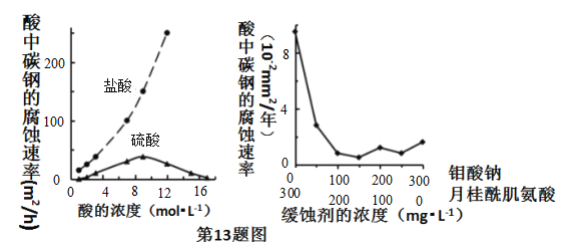
A.盐酸的浓度越大,腐蚀速率越快
B.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
C.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
D.对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:

(1)甲装置常常浸在70~80℃的水浴中,目的是____________________。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为______________。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_______、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在___________中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热定容的密闭容器中,1molA与2molB发生反应A(g)+2B(g) ![]() xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法不正确的是
xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法不正确的是
A.平衡时,A和B的转化率相等
B.若 x=1,容器中压强不变时不能判断反应达到平衡
C.当B和D的物质的量之比1:1不变时,表明该反应已达到平衡
D.达到平衡过程中,正反应速率可能是先增大再减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO、Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
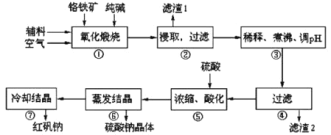
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是________。
(2)“③”中调节pH至4.7,目的是________。
(3)“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式:________。
,请写出该平衡转化的离子方程式:________。
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶(锥形瓶)中,加入10mL2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol·L-1Na2S2O3标准溶液滴定(I2+2![]() =2I-+
=2I-+![]() )。
)。
①判断达到滴定终点的依据是:________;
②若实验中共用去Na2S2O3标准溶液40.00mL,所得产品的中Na2Cr2O7的纯度(设整个过程中其它杂质不参与反应)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S16O2与18O2在高温条件下发生反应2SO2+O2![]() 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )
A.NO![]() 和NH
和NH![]() B.H3O+和ClO
B.H3O+和ClO![]()
C.NO![]() 和CO
和CO![]() D.PO
D.PO![]() 和SO
和SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com