
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。

已知:i.PbCl2微溶于水
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)△H>0
PbCl42-(aq)△H>0
(1)浸取过程中MnO2与PbS发生如下反应,请将离子反应补充完整并配平:_____
______+___Cl-+___PbS+___MnO2=___PbCl2+__SO42-+_____ +_____
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是__________。
(3)调pH的目的是____________。
(4)沉降池中获得PbCl2采取的措施有_________。
(5)通过电解酸性废液可重新获得MnO2,装置示意图如下:
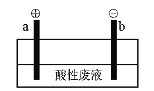
①在_____极(填“a”或“b”)获得MnO2,电极反应为_______________。
②电解过程中发现有Cl2产生,原因可能是_____________(用化学用语表示)。
【答案】8H++2Cl-+PbS+4MnO2=PbCl2+SO42-+4Mn2++4H2O PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),加入NaCl增大c(Cl-),有利于平衡正向移动,将PbCl2(s)转化为溶液中的离子,消除“钝化层” 除去溶液中的Fe3+ 加水稀释、降温 a Mn2+-2e-+2H2O=MnO2+4H+ 2Cl--2e-=Cl2↑或(MnO2+4HCl=MnCl2+Cl2↑+2H2O)
PbCl42-(aq),加入NaCl增大c(Cl-),有利于平衡正向移动,将PbCl2(s)转化为溶液中的离子,消除“钝化层” 除去溶液中的Fe3+ 加水稀释、降温 a Mn2+-2e-+2H2O=MnO2+4H+ 2Cl--2e-=Cl2↑或(MnO2+4HCl=MnCl2+Cl2↑+2H2O)
【解析】
方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)中加入稀盐酸,根据酸性废液中含有硫酸根离子矿渣,PbS中S元素被氧化成硫酸根离子,则发生反应为4MnO2+PbS+8HCl=3MnCl2+PbCl2+MnSO4+4H2O,加入NaCl促进反应PbCl2(s)+2Cl-(aq)PbCl42-(aq),加入NaOH溶液调节溶液pH,使铁离子转化成氢氧化铁沉淀,过滤得到氢氧化铁、矿渣和滤液;PbCl2微溶于水,将溶液沉降过滤得到PbCl2;电解酸性废液(Mn2+、SO42-、Cl-)可重新获得MnO2,连接电源正极为阳极,发生氧化反应,连接电源负极为阴极,发生还原反应,据此解答。
(1)浸取过程中MnO2与PbS发生反应4MnO2+PbS+8HCl=3MnCl2+PbCl2+MnSO4+4H2O,离子反应为:8H++2Cl-+PbS+4MnO2=PbCl2+4Mn2++SO42-+4H2O;
(2)浸取剂中加入饱和NaCl溶液可有效避免钝化层的原因为:已知PbCl2(s)+2Cl-(aq)PbCl42-(aq),加入NaCl增大c(Cl-),有利于平衡正向移动,将PbCl2(s)转化为溶液中的离子,消除“钝化层”;
(3)根据流程可知调节溶液pH,使铁离子转化成氢氧化铁沉淀,除去溶液中的Fe3+;
(4)已知:PbCl2(s)+2Cl-(aq)PbCl42-(aq)△H>0,可以通过加水稀释、降温促进反应逆向进行,获得PbCl2;
(5)①酸性废液(Mn2+、SO42-、Cl-),得到MnO2,故Mn2+失去电子发生氧化反应得到MnO2,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,为阳极,则连接a极;
②酸性废液中有氯离子,可能在阳极放电得到氯气,也可能被生成的二氧化锰氧化得到氯气,涉及的反应为:2Cl--2e-=Cl2↑、MnO2+4HCl=MnCl2+Cl2↑+2H2O。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】实验室欲配制480mL0.2mol·L-1的NaOH溶液。
(1)通过计算可知,应用托盘天平称量_____克NaOH固体。
(2)本实验所需要的玻璃仪器除量筒、胶头滴管、烧杯外还有_____。
(3)从下面选出所需的操作并写出正确的顺序_____(填字母)。
A.洗涤 B.冷却 C.量取 D.称量 E.定容 F.转移溶液 G.稀释 H.溶解
(4)在实验过程中出现如下情况对所配溶液的浓度有何影响(填“偏高”或“偏低”或“无影响”)。
①定容时加蒸馏水不慎超过了刻度_____;
②容量瓶不干燥,有一定的水分_____;
③定容时仰视观察到液面刚好到达刻度线_____。
(5)该NaOH溶液与2.24L氯气(STP)下恰好完全反应,需氢氧化钠溶液_____mL。
(6)用18mol·L-1的硫酸配制100mL1.0 mol·L-1硫酸,实验时应选用的仪器是_____(填编号)。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g。则:
(1)混合气体的密度是_______。(结果保留两位小数)
(2)CO和CO2的物质的量之比是________。
(3)CO的体积分数是________,CO的质量分数是________。
(4)混合气体中所含氧原子的物质的量是_________,所含碳原子的物质的量是_________。
(5)混合气体的平均摩尔质量是_________,对氢气的相对密度是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的检验,其结论一定正确的是( )
A. 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B. 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32-
C. 取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加盐酸有气体产生,加BaCl2有白色沉淀产生。说明Na2SO3样品已部分被氧化
D. 将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要用途,如聚合硫酸铁 是一种新型高效的水处理混凝剂,而高铁酸钾
是一种新型高效的水处理混凝剂,而高铁酸钾![]() 其中铁的化合价为
其中铁的化合价为![]() 是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
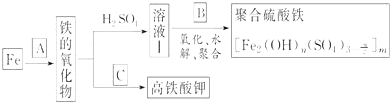
请回答下列问题:
![]() 若A为
若A为![]() ,写出反应方程式:______.
,写出反应方程式:______.
![]() 若B为
若B为![]() 与稀硫酸,写出其氧化
与稀硫酸,写出其氧化![]() 的离子方程式
的离子方程式![]() 还原产物为
还原产物为![]() ______.
______.
![]() 若C为
若C为![]() 和KOH的混合物,写出其与
和KOH的混合物,写出其与![]() 加热共融制得高铁酸钾
加热共融制得高铁酸钾![]() 的化学方程式,并配平:
的化学方程式,并配平:
![]() ______
______![]() ______
______
![]() 为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取
为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取![]() 溶液Ⅰ于带塞锥形瓶中,,加入足量
溶液Ⅰ于带塞锥形瓶中,,加入足量![]() ,调节
,调节![]() ,加热除去过量
,加热除去过量![]() ;加入过量KI充分反应后,再用
;加入过量KI充分反应后,再用![]() 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液![]() 。
。
已知:
![]()
![]()
滴定选用的指示剂及滴定终点观察到的现象______.溶液Ⅰ中铁元素的总含量为______![]() 若滴定前溶液中
若滴定前溶液中![]() 没有除尽,所测定的铁元素的含量将会______
没有除尽,所测定的铁元素的含量将会______![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知T℃时AgCl的Ksp=2×1010;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
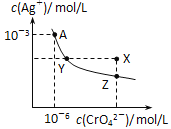
A. T℃时Ag2CrO4的Ksp=1×108
B. Y和Z点Ag2CrO4的Ksp不相同
C. 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
D. 浓度均为2×106molL﹣1AgNO3与NaCl溶液等体积混合无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用下列仪器组装一套装置来测定黄铁矿(主要成分FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)。实验的正确操作步骤如下:
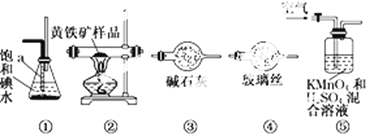
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0 g样品小心地放入硬质玻璃管中
D.以1 L/min的速率鼓入空气
E.将硬质玻璃管中的黄铁矿样品加热到800℃~850℃
F.用300 mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O = 2HI+H2SO4
G.吸收液用CCl4萃取、分离
H.取20.00mLG中所得溶液,用0.2000mol·L-1的NaOH标准溶液滴定。试回答:
(1)步骤G中所用主要仪器是______,应取_______ (填“上”或“下”)层溶液进行后续实验。
(2)装置正确的连接顺序是 ![]()
![]()
![]() ④
④ ![]() (填编号)。______
(填编号)。______
(3)装置⑤中高锰酸钾的作用是__________。持续鼓入空气的作用__________。
(4)步骤H中滴定时应选用_____作指示剂,可以根据________现象来判断滴定已经达到终点。
(5)假定黄铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收,滴定得到的数据如下表所示:
滴定次数 | 待测液的体积/mL | NaOH标准溶液的体积/mL | |
滴定前 | 滴定后 | ||
第一次 | 20.00 | 0.00 | 20.48 |
第二次 | 20.00 | 0.22 | 20.20 |
第三次 | 20.00 | 0.36 | 20.38 |
则黄铁矿样品中硫元素的质量分数为___________。
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置①所得吸收液中加入下列哪种试剂__________ 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知过氧化铬(CrO5)的结构式如下图所示,过氧化铬不稳定,溶于水生成过氧铬酸;溶于酸生成铬(III)盐(绿色)并放出氧气,反应方程式为:4CrO5+12H+=4Cr3++7O2+6H2O)。下列有关说法正确的是( )
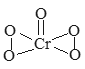
A. CrO5中Cr元素的化合价为+10
B. 过氧化铬中含有极性共价键、非极性共价键和离子键
C. 过氧化铬具有较强的氧化性
D. 上述反应每转移0.2mol电子就能生成2.24LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5molCO2中含有_______个CO2分子,_______mol氧原子, ______个碳原子,CO2的质量为__________ g,标况下体积为_________ L。![]() 11.1g的ACl2中含有0.2molCl-,ACl2的物质的量是__________,ACl2的摩尔质量是__________,A的相对原子质量是________。
11.1g的ACl2中含有0.2molCl-,ACl2的物质的量是__________,ACl2的摩尔质量是__________,A的相对原子质量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com