
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
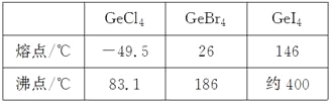
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
【答案】3d104s24p2 2 Ge原子半径大,原子间形成的σ单键较长,pp轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键 GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强 O>Ge>Zn sp3 共价键 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为[Ar]3d104s24p2;
(2)Ge原子半径大,难以通过“肩并肩”方式形成π键;
(3)锗的卤化物都是分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高;
(4)元素的非金属性越强,吸引电子的能力越强,元素的电负性越大;
(5)①Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体;②Ge单晶具有金刚石型结构,则晶胞中Ge原子数目为8,结合阿伏伽德罗常数表示出晶胞的质量,再根据ρ=m/V计算晶胞密度。
(1)锗为32号元素,根据原子核外电子的排布规律,可写出其电子排布式为1s22s22p63s23p63d104s24p2,其核外电子排布简式为[Ar]3d104s24p2,其中4p能级有2个未成对电子,故答案为:3d104s24p2;2;
(2) 虽然Ge与C是同族元素,C原子之间可以形成双键、叁键,但考虑Ge的原子半径大,难以通过“肩并肩”方式形成π键,所以Ge原子之间难以形成双键或叁键,
故答案为:Ge原子半径大,原子间形成的σ单键较长,pp轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键;
(3)由表中数据可知,锗的卤化物都是分子晶体,分子间通过分子间作用力结合,对于组成与结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,由于相对分子质量:GeCl4<GeBr4<GeI4,故沸点:GeCl4<GeBr4<GeI4,故答案为:GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强;
(4)Zn、Ge、O三种元素中,Zn和Ge是金属元素,O是非金属元素。O的电负性比Zn和Ge的大,又根据同周期元素的电负性从左到右逐渐增大的规律,可知电负性:O>Ge>Zn,故答案为O>Ge>Zn;
(5)由于锗单晶具有金刚石型的结构,故每个锗原子与相邻的四个锗原子形成四个共价键,其原子轨道杂化类型为sp3杂化,故答案为: sp3 ;共价键;
(6)①由Ge单晶晶胞结构示意图,可知D原子与A原子及位于3个相邻面面心的3个原子构成了正四面体结构,D原子位于正四面体的中心,再根据A、B、C三个原子的坐标参数可知D原子的坐标参数为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );②由锗单晶的晶胞结构示意图,可知该晶胞中位于顶点的有8个原子,位于面心的有6个原子,位于内部的有4个原子,则一个晶胞中所含有的锗原子个数为8×
);②由锗单晶的晶胞结构示意图,可知该晶胞中位于顶点的有8个原子,位于面心的有6个原子,位于内部的有4个原子,则一个晶胞中所含有的锗原子个数为8×![]() +6×
+6×![]() +4=8,再由晶胞参数可知该晶胞的边长为565.76 pm的正方体,则其密度为:
+4=8,再由晶胞参数可知该晶胞的边长为565.76 pm的正方体,则其密度为:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法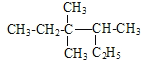 的名称为3,3-二甲基-2-乙基戊烷
的名称为3,3-二甲基-2-乙基戊烷
B. 分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种
C. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
D. 乙烯和苯均能使溴水因发生化学反应褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列要求填写以下空格:
(1)-COOH的名称是 ________________,
(2)-CHO的名称是___________________
(3)写出羟基的化学式_______________________
(4)苯的结构简式是_______________
(5)写出乙酸与碳酸钠反应的化学方程式______________________________________________ ,
该反应说明,乙酸的酸性____(填强或弱)于碳酸 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+ O2 (g)![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器
2SO3(g),其正反应放热。现有三个体积相同的密闭容器
I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A. 容器I、III中平衡常数相同
B. 容器II、III中正反应速率相同
C. 容器II、III中的反应达平衡时, SO3的体积分数:II > III
D. 容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2C12)常用于制造医药品、染料等。通常情况下其熔点为-54.1℃,沸点69.2℃,遇水发生剧烈反应生成氯化氢气体。某实验小组拟用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯,其实验装置如下:

(1)有关冷凝管的使用原理,下列说法正确的是(填字母)______________。
a.蒸气冷凝在内管的外壁上
b.当蒸馏液体的沸点超过140℃,水冷易炸裂仪器,此时多采用空气冷凝管
c.蛇形冷凝管多用于有机制备的回流,适用于沸点较低的液体
d.内外管所围出的空间为行水区,有吸收蒸气热量并将热量移走的功用
(2)B中的试剂为___________,作用为______________________________。
(3)在不改变装置的前提下,丁中的KClO3可用_____________代替(填化学式)。
(4)该小组向Cu(NO3)2·3H2O晶体中滴加SO2C12制备少量无水Cu(NO3)2。
①请写出SO2C12与水反应的化学方程式__________________________________。
②滴加SO2C12的作用除了吸水之外,还有_____________________________。
(5)测定无水Cu(NO3)2的纯度,可用分光光度法。现测得[Cu(NH3)4]2+的吸光度A与Cu2+标准浓度关系如图所示(已知4NH3·H2O+Cu2+==[Cu(NH3)4]2++4H2O)。
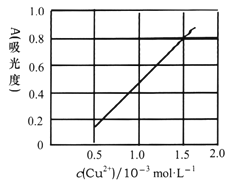
称取0.3150g制得的无水Cu(NO3)2样品,用蒸馏水溶解并配制成100mL溶液,用__________(填仪器名称)准确量取10.00mL,加过量氨水,再用蒸馏水稀释至100mL,测得其吸光度A=0.8。则此无水Cu(NO3)2样品的纯度是___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关第114号和第116号两种元素的说法错误的是( )
A. 两种元素位于同一周期 B. 116号元素位于ⅥA族
C. 两种元素都是活泼的非金属元素 D. 114号元素与Si元素在同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是___________。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
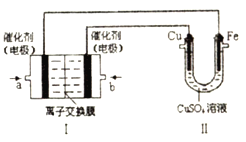
如图,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式是___________。若只把Ⅱ中电极均换为惰性电极,电解时的化学反应方程式为___________。若把Ⅱ中电极均换为惰性电极,电解液换为含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH=___________(假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 含有金属元素的离子—定是阳离子
B. 含有离子键和共价键的化合物一定是离子化合物
C. 目前使用的元素周期表中,最长的周期含有36种元素
D. 第ⅦA族元素的阴离子还原性越强,其最高价氧化物的水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A. 第三周期第IA族 B. 第四周期第IA族
C. 第五周期第IA族 D. 第二周期第IIA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com