

分析 A与硝酸银溶液、稀硝酸生成白色沉淀,可知A中含有Cl-;B与氯化钡溶液、盐酸生成白色沉淀,可知B中含有SO42-;X、Y、H2O生成Cl-和SO42-且X、Y均是有刺激性气味的气体,可推知X、Y是二氧化硫和氯气,反应为SO2+Cl2+2H2O=H2SO4+2HCl;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4.
解答 解:A与硝酸银溶液、稀硝酸生成白色沉淀,可知A中含有Cl-;B与氯化钡溶液、盐酸生成白色沉淀,可知B中含有SO42-;X、Y、H2O生成Cl-和SO42-且X、Y均是有刺激性气味的气体,可推知X、Y是二氧化硫和氯气,反应为SO2+Cl2+2H2O=H2SO4+2HCl;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4.
(1)由以上分析可知X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3,
故答案为:Cl2;SO2;HCl;H2SO4;FeCl3;
(2)反应①的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,反应②的离子方程式为反应的离子方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,
故答案为:Cl2+SO2+2H2O═2HCl+H2SO4;2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
(3)Y为SO2,具有漂白性,可以使品红溶液褪色,溶液是呈酸性,使紫色石蕊试液变红色,具有还原性,可以被酸性高锰酸钾溶液、溴水氧化,使它们溶液颜色褪去,
故选:ACD;
(4)为防止X(氯气)气体污染空气,可用NaOH溶液吸收,原理是(用离子方程式表示):Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O.
点评 本题考查无机物的推断,A、B分别为硝酸银、氯化钡反应现象为推断突破口,侧重于学生的分析能力和元素化合物知识的综合运用的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | N2→NO→NO2 | B. | Fe→FeCl2→Fe (OH)2 | C. | S→SO3→H2SO4 | D. | Na→Na2O2→NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
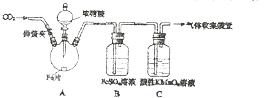 甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | / |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
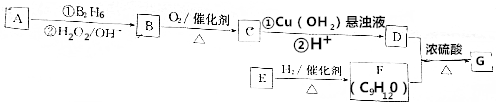
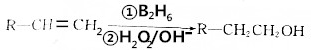
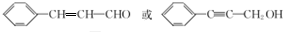 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | |||||||
| B | C | D | |||||
| E | F | G | H | I | |||
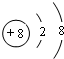 ,E与I形成的化合物的电子式为
,E与I形成的化合物的电子式为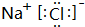 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com