
分析 (1)碳酸钠一定在氯化钡之后,最后加盐酸除去过量的碳酸钠;
(2)等质量的碳酸钠和碳酸氢钠,由$\frac{m}{106}$<$\frac{m}{84}$可知,碳酸氢钠的物质的量大,结合碳原子守恒分析;
(3)碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳;
(4)碳酸钠、水、二氧化碳反应生成碳酸氢钠.
解答 解:(1)粗盐中含有可溶性CaCl2、MgCl2 Na2SO4杂质,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,碳酸钠一定在氯化钡之后,最后加盐酸除去过量的碳酸钠,则加入试剂的先后顺序可以是②③①④(或 ③②①④),
故答案为:②③①④(或 ③②①④);
(2)等质量的碳酸钠和碳酸氢钠,由$\frac{m}{106}$<$\frac{m}{84}$可知,碳酸氢钠的物质的量大,由碳原子守恒可知,生成CO2的量前者<后者,故答案为:<;
(3)碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,离子反应为HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O;
(4)除去NaHCO3溶液中的少量Na2CO3,方法是通入足量的CO2,发生的离子反应为CO32-+CO2+H2O=2HCO3-,
故答案为:通入足量的CO2;CO32-+CO2+H2O=2HCO3-.
点评 本题考查离子反应方程式的书写及混合物分离提纯,为高频考点,把握物质的性质、发生的反应及离子反应的书写为解答的关键,侧重分析与应用能力的考查,注意钠的化合物的性质及转化,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:实验题
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa、25℃时,16gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ.N2H4完全燃烧反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa、25℃时,16gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ.N2H4完全燃烧反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
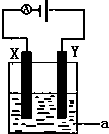 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型  | ||
| C. | 氢氧根离子的电子式: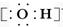 | D. | NH4Br的电子式: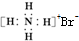 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这是一种矿物胶,既不燃烧也不受腐蚀 | |
| B. | 在建筑工业上可以作黏合剂、耐酸水泥掺料 | |
| C. | 木材、织物浸过水玻璃后具有防腐性能且不易燃烧 | |
| D. | 水玻璃的化学性质稳定,在空气中不易变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com