
如下图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X(g)+Y(g) 2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是
2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是
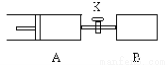
A.反应速率:v(B)>v(A) B.A容器中X的转化率为80%
C.平衡时Y体积分数:A<B D.打开活塞K重新达平衡VA=2.2aL
D
【解析】
试题分析:A.对X (g)+Y(g) 2Z(g)+W(g)来说,开始时只加入反应物X和Y,该反应将向正反应发向进行以建立化学平衡.对容器A来说,在建立化学平衡的过程中,反应混合物的总物质的量会增大,根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),其体积要增大,各组分的物质的量浓度就要减下,其反应速率也要减小.对于B容器来说,体积不变,各组分初始浓度是A容器的2倍,每个时刻的反应速率都将大于A容器,即反应速率:v(B)>v(A),A正确;B.根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),达平衡后,混合气体的物质的量是初始时物质的量的1.4倍,即1.4×2mol=2.8mol,即增加了0.8mol,根据化学方程式的计算可知,
2Z(g)+W(g)来说,开始时只加入反应物X和Y,该反应将向正反应发向进行以建立化学平衡.对容器A来说,在建立化学平衡的过程中,反应混合物的总物质的量会增大,根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),其体积要增大,各组分的物质的量浓度就要减下,其反应速率也要减小.对于B容器来说,体积不变,各组分初始浓度是A容器的2倍,每个时刻的反应速率都将大于A容器,即反应速率:v(B)>v(A),A正确;B.根据阿伏伽德罗定律(同温同容时,压强之比等于物质的量之比),达平衡后,混合气体的物质的量是初始时物质的量的1.4倍,即1.4×2mol=2.8mol,即增加了0.8mol,根据化学方程式的计算可知,
X (g)+Y(g) =2Z(g)+W(g)△n
=2Z(g)+W(g)△n
1 1
0.8mol 0.8mol
即达平衡后,反应掉0.8mol,A容器中X的转化率为80%,B正确;C.根据C项中A容器的平衡变化,建立新平衡后,(容积为0.5aL与容积为1.4aL相比)Y的体积分数要减小,即平衡时Y体积分数A<B,C正确;D.打开K达新平衡等效为A中到达的平衡,X的转化率为80%,参加反应的X的总的物质的量为3mol×80%=2.4mol,则:
X(g)+Y(g)?2Z(g)+W(g) 物质的量增多
1mol 1mol
2.4mol 2.4mol
故平衡后容器内总的物质的量为(1mol+1mol+2mol+2mol)+2.4mol=8.4mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为aL× =4.2aL,则A的体积=4.2aL-a=3.2a,D错误;答案选D。
=4.2aL,则A的体积=4.2aL-a=3.2a,D错误;答案选D。
考点:考查化学平衡的影响因素及计算。


科目:高中化学 来源:2014-2015河南省高一上学期第三次考试化学试卷(解析版) 题型:选择题
下列各组离子中,在强碱性溶液中一定能共存的是
A.Na+、Fe2+、Clˉ、SO42ˉ B.Na+、K+、SO42ˉ、Clˉ
C.K+、Na+、HCO3ˉ、NO3ˉ D.K+、Clˉ、Al3+、CO32ˉ
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高一上学期月考化学试卷(解析版) 题型:选择题
向一定量的Cu、Fe2O3的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A.3.2 g B.2.4 g C.1.6 g D.0.8 g
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:填空题
(共7分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI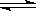 H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
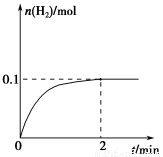
0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g) 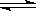 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:选择题
下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,会降低反应速率,可提高N2、H2的转化率
B.从海水中提镁过程中,电解熔融MgO可制备Mg
C.电解精炼铜时,同一时间内阳极溶解固体的质量比阴极析出固体的质量小
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.物质的溶解性为难溶,则该物质不溶于水
B.不溶于水的物质溶解度为0
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.绝对不溶解的物质是不存在的
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二上学期1月质量检测化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高二上学期期中化学试卷(解析版) 题型:填空题
(12分)(1)将一定量氨气通入盐酸中,溶液pH恰好为7(25 ℃),则氨的物质的量_____(填“<”、“=”或“>”)盐酸中HCl的物质的量;溶液中c(NH4+)_____c(Cl-)。
(2)向同体积同物质的量浓度的盐酸和氯化铵溶液中加入等质量的镁粉,镁完全反应后,盐酸放出气体的体积_____氯化铵溶液放出气体的体积。
(3)向盐酸中通入NH3至恰好完全反应时,所得溶液由H2O电离出来的c(H+)比纯水电离出来的c(H+)_____(填“大”、“小”或“相等”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com