
下列叙述和推论都正确的是叙述
叙述 | 推论 | |
A | 酸性:HCl>H2CO3>H2SiO3 | 非金属性:Cl>C>Si |
B | 组成原电池时,通常是还原性较强的物质做负极 | 镁和铝在氢氧化钠溶液中组成原电池时,镁做负极 |
C | —OH是亲水基,含有—OH的有机物都易溶于水 | 常温时,C2H5OH和 |
D | 溶解度小的沉淀可转化成溶解度更小的沉淀 | 向AgCl的悬浊液中滴加KI溶液可以得到AgI沉淀 |
 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2014-2015浙江省杭州市下学期高二4月月考化学试卷(解析版) 题型:选择题
下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是
A.CH3Cl
B.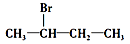
C.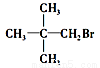
D.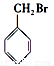
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:填空题
选做(12分)【化学——物质结构与性质】A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。
(1)在第3周期中,第一电离能大于B的元素有 种;A与B形成晶体的晶胞如图所示,该晶胞实际拥有Bn-的数目为 ;
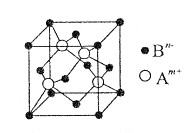
(2)B的氢化物(H2B)分子的空间构型为 ;
在乙醇中的溶解度:sH2C)>s(H2B),其原因是 。
(3)B与C可形成BC42-
①BC42-中,B原子轨道的杂化类型是 。
②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC42-互为等电子体的分子的化学式为 (写出一种即可)。
(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有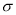 键的物质的量为 mol。
键的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第二次模拟化学试卷(解析版) 题型:填空题
(15分)元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
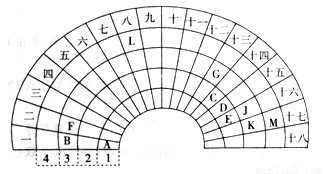
(1)元素C的最高价氧化物的电子式为 ;元素G的离子结构示意图为 。
(2)元素L位于周期表的第 族,1mol/L LM2溶液500ml与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_____性,原因是____________(用离子方程式表示)。
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为 。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第二次模拟化学试卷(解析版) 题型:选择题
化学与科技、社会、生产、生活密切相关。下列有关说法不正确的是
A.物质燃烧时产生有色火焰的都是焰色反应的见证
B.棉花、木材和植物秸秆的主要成分都是纤维素
C.航天服主要成分由碳化硅陶瓷和碳纤维复合而成,是一种复合材料
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省“江淮十校”高三4月联考理综化学试卷(解析版) 题型:选择题
下列各组微粒在指定溶液中一定能大量共存的是
A.石蕊变红色的溶液:Na+ .Mg2+ Cl—、SO2-4
B.能溶解氧化铝粉末的溶液中:K+、N0-3、Cl-、NH4+
C.滴加苯酚溶液显紫色的溶液:NH4,K+、Cl-、H2S
D.由水电离出的c ( H+)=10-12mol.L-1的溶液:Na+、K+、.NO3-、C6H5O—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市、石嘴山市高三四月联考理综化学试卷(解析版) 题型:简答题
(15分)“霾”是当今世界环境热点话题。目前宁夏境内空气质量恶化原因之一是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+ 2CO(g) 2CO2(g)+ N2(g) △H=﹣a kJmol-1(a>0)
2CO2(g)+ N2(g) △H=﹣a kJmol-1(a>0)
(1)在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
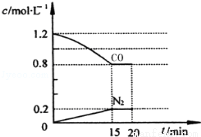
①0~15min N2的平均速率v(N2)= ;NO的转化率为 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积
b.增加CO的量
c.降低温度
d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”),重新达到平衡后,该反应的化学平衡常数为 。
(2)已知:2NO(g)+ O2(g)=2NO2(g) △H=﹣b kJmol-1(b>0)
CO的燃烧热△H=﹣c kJmol-1 (c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应
的热化学反应方程式为: 。
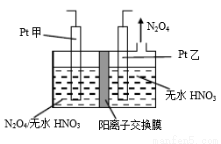
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为 极,电解池中生成N2O5的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.粗锌与稀硫酸反应比纯锌快,说明粗锌中含有更活泼的金属
B.新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色
C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA-的电离程度大于其水解程度
D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的ΔH<0,ΔS>0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市高三质量监测三理综化学试卷(解析版) 题型:选择题
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列说法正确的是
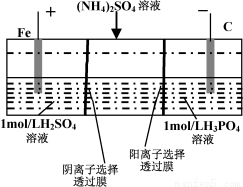
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为:4OH–-4e–=2H2O+O2↑
C.电解一段时间后,阴极室溶液中的pH升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com