
【题目】(1)下列有机物中属于脂肪烃的是________(填序号,下同),属于芳香烃的是________,属于苯的同系物的是________,属于脂环烃的是________。
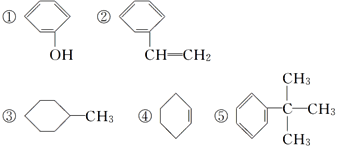
(2)烃A的相对分子质量是106,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。当用FeBr3作催化剂时,能与溴反应,生成的一溴代物只有一种,则烃A的名称是________,它生成一溴代物的化学方程式是___________________。
【答案】③④⑥②⑤⑤③④对二甲苯
【解析】
(1)脂肪烃是指链状烃,含有苯环的烃是芳香烃,不含苯环的环状化合物是脂环烃,苯分子中的氢原子被烷烃基取代后的产物是苯的同系物。(2)烃A的相对分子质量是106,则分子中最大C原子数目为![]() =8…10,可知A的分子式为C8H10,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,说明为苯的同系物,当用FeBr3作催化剂时,能与溴反应生成的一溴代物只有一种,则含有2个甲基且处于对位。
=8…10,可知A的分子式为C8H10,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,说明为苯的同系物,当用FeBr3作催化剂时,能与溴反应生成的一溴代物只有一种,则含有2个甲基且处于对位。
(1)脂肪烃中只含C、H元素,为链烃基结构,只有⑥属于脂肪烃;②⑤是含有苯环的碳氢化合物,属于芳香烃;⑤的侧链是烷基,只有一个苯环,符合通式CnH2n-6(n≥6),属于苯的同系物;③④是一类性质和脂肪族化合物相似的碳环化合物,属于脂环化合物。(2)烃A的相对分子质量是106,则分子中最大C原子数目为![]() =8…10,可知A的分子式为C8H10,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,说明为苯的同系物,当用FeBr3作催化剂时,能与溴反应生成的一溴代物只有一种,则含有2个甲基且处于对位,结构简式为
=8…10,可知A的分子式为C8H10,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,说明为苯的同系物,当用FeBr3作催化剂时,能与溴反应生成的一溴代物只有一种,则含有2个甲基且处于对位,结构简式为![]() ,名称为对二甲苯,反应的化学方程式为
,名称为对二甲苯,反应的化学方程式为 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】对于有气体参加的反应,一定能使化学反应速率加快的因素是( )
①扩大容器的容积 ②使用正催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大容器内的压强
A.②③B.②③④⑥C.②④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ.(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1_____________________,t3_____________________,t4_____________________。
(2)下列时间段中,氨的百分含量最高的是(_______)
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.人类能够有效利用氮气的主要途径是合成氨,生产化学肥料等。
完成下列填空:
(1)氮原子核外电子排布式为__________,其最外层有_______种运动状态不同的电子;氮气的电子式为______________;氨气分子的空间构型是______________。
(2)工业上常用醋酸亚铜氨溶液来吸收含有大量N2的高炉气体系中的CO,从而实现CO和N2的分离,反应的化学方程式如下:CH3COOCu(NH3)2 (aq) + CO(g)![]() CH3COOCu(NH3)2·CO(aq) + Q(Q>0),该反应的化学平衡常数表达式K=________;欲使K值变大,可采取的措施是_______。
CH3COOCu(NH3)2·CO(aq) + Q(Q>0),该反应的化学平衡常数表达式K=________;欲使K值变大,可采取的措施是_______。
吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的适当处理措施有
_____________(选填序号)。
a.适当升高温度 b.适当降低温度 c.增大压强 d.减小压强
(3)消除NH3对水体污染的重要方法是在一定条件下向水体中加入适量NaOH,这样能使NH3的脱除率增大,试用平衡移动原理解释其原因______________________________。
II.为实现CO2减排,合成氨工厂采用苯菲尔法脱碳。该方法是用碳酸钾溶液为吸收剂捕集混合气中的CO2得到富液,再高温加热富液使之分解释放出CO2 ,正常情况下再生的二氧化碳气体体积分数可达98.5%以上。
(4)某研究小组用200mL 1.5mol/L K2CO3溶液吸收了3.36L 的CO2(标准状况)形成富液,碳酸钾溶液吸收CO2的离子反应方程式为______________________________,该富液中的溶质是____________(填化学式),各离子的浓度关系正确的是_________。
a.c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
b.3c(K+)=4 c(CO32-)+4 c(HCO3-)+4c(H2CO3)
c.c(K+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双环戊二烯( )主要用于制医药,农药,树脂制品,常存在于煤焦油中。下列叙述不正确的是
)主要用于制医药,农药,树脂制品,常存在于煤焦油中。下列叙述不正确的是
A. 从煤的干馏产物中可分离出苯,甲苯等基本化工原料
B. 双环戊二烯与蓝烷( )互为同分异构体
)互为同分异构体
C. 双环戊一烯能与溴的四氧化碳溶液发生取代反应
D. 双环戊一烯所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为____________;名称是________。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式_______________________。
(2)若核磁共振氢谱显示链烃A中有三个峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水.据此判断下列分析中不正确的是
A. 此混合气体中可能含有乙烷
B. 此气体中一定含有甲烷
C. 此混合气体中一定不含有丙烷
D. 此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com