
工业上,通过如下转化可制得KClO3晶体:
NaCl溶液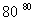 NaClO3溶液
NaClO3溶液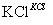 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式:NaCl+H2O===NaClO3+__________。
②Ⅱ中转化的基本反应类型是________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是________________________________________________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
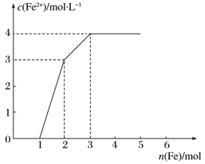
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.按系统命名法,化合物 的名称为2,6二甲基3乙基庚烷
的名称为2,6二甲基3乙基庚烷
B.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽
C.化合物 是苯的同系物
是苯的同系物
D.三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL
C.30 mL D.15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:Cu2O+2H+===Cu+Cu2++H2O,则可用来检验氢气还原CuO所得的红色固体中是否含Cu2O的试剂是( )
A.稀硝酸 B.浓硝酸
C.盐酸 D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
8NH3和NO2在催化剂作用下反应:8NH3+6NO2===7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是( )
A.转移电子2.4NA个
B.生成气体的体积42.56 L(标准状况)
C.还原剂比氧化剂多0.2 mol
D.被还原的氮原子是11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下所示:

(1)验证固体W焙烧后产生的气体中含有SO2的方法是
________________________________________________________________________。
(2)制备绿矾时,向溶液X中加入过量__________,充分反应后,经__________操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________________________________________________________________________。
若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
使用氯化钠作原料可以得到多种产品。
(1)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的物质的量浓度是______________(忽略反应前后溶液体积的变化)。
(2)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。

对电源电极名称和消毒液的主要成分判断正确的是________(填字母序号)。
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
(3)实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。某同学利用上图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色。该同学换上的电解材料是__________(用元素符号表示),总的反应式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com