
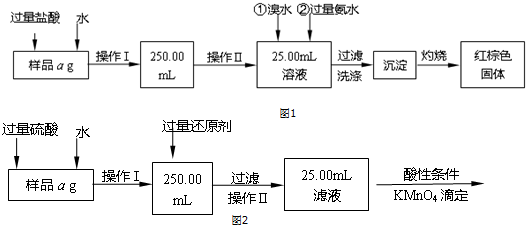
分析 采取的方法是加入盐酸和水使样品溶解,在容量瓶中配制250ml溶液,量取25.00ml溶液,加入溴水将亚铁离子氧化成铁离子、加入氨水使铁离子沉淀,过滤将所得氢氧化铁灼烧最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数,
Ⅰ、(1)根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
(2)根据Cl2具有氧化性,能氧化Fe2+;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;根据铁元素质量守恒,即红棕色固体( Fe2O3)中的铁就是样品中铁,根据质量分数的公式求出铁元素的质量分数;
样品ag加入过量硫酸和水配制250ml溶液,加入过量还原剂还原过滤取用25ml溶液在酸性条件下用高锰酸钾溶液滴定,发生反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,
Ⅱ、(1)某氯化铁与氯化亚铁的混合物.现要测定其中铁元素的质量分数,加入铁做还原剂和过量的硫酸反应生成亚铁离子,会增加铁元素的量对测定结果产生误差;
(2)依据高锰酸钾和亚铁离子的氧化还原反应定量关系计算.
解答 解:Ⅰ、(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,操作I所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有250mL容量瓶,
故答案为:250mL容量瓶;
(2)因氯水中Cl2具有氧化性,能氧化Fe2+:2Fe2++Cl2=2Fe3++2Cl-,为了使Fe3+充分沉淀,氨水要过量,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×$\frac{112}{160}$,
样品中铁元素的质量分数是$\frac{1120({W}_{2}-{W}_{1})}{160a}$×100%,
故答案为:再次加热冷却并称量,直至两次质量差小于0.1g;$\frac{1120({W}_{2}-{W}_{1})}{160a}$×100%;
Ⅱ.(1)还原剂不能用铁,因为有铁粉会和过量硫酸反应生成硫酸亚铁,铁自身的氧化产物是Fe2+,再用高锰酸钾滴定,多消耗氧化剂产生误差,干扰原混合物的铁元素的测定,
故答案为:否;如果用铁做还原剂,自身的氧化产物是Fe2+,且会与过量的硫酸反应生成Fe2+,干扰铁元素的测定;
(2)反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,依据定量关系计算得到,设铁元素质量分数为X%,
5Fe2+~5Fe3+~KMnO4
5×56 1
a×X%×$\frac{25.00}{250.0}$ c×b×10-3
铁元素的质量分数是X%=$\frac{280bc}{a}%$,
故答案为:$\frac{280bc}{a}%$.
点评 本题主要考查了铁元素的质量分数的测定,实验分析,实验数据的计算应用,同时考查了实验知识的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固态>液态>气态 | B. | 液态>固态>气态 | C. | 气态>液态>固态 | D. | 气态>固态>液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发结晶操作时,当有大量晶体析出时停止加热,用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球插入液态混合物中 | |
| C. | 分液操作时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| D. | 萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
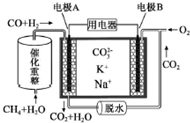
| A. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移6mol 电子 | |
| B. | 电极A上CO参与的电极反应为:CO+CO32--2e-═2CO2↑ | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为KClO4(s)+8e?═KCl(s)+4O2?(l) | |
| B. | 在该热电池中,铁为负极,发生还原反应 | |
| C. | △H参与反应的高氯酸钾越多,其值越小 | |
| D. | 生成1 mol FeO转移8 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论乙烯的加成,还是乙烷的取代反应都可制得溴乙烷 | |
| B. | 无论使用溴水或KMnO4溶液都可以鉴别乙烯和乙烷 | |
| C. | 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| D. | 乙烯的化学性质比乙烷的化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com