
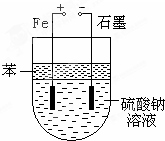
 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
| ||
| ||


科目:高中化学 来源: 题型:
| A、FeCl3 |
| B、KCl |
| C、ZnCl2 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷 | B、乙烷 | C、丁烷 | D、戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| B、应用高效洁净的能源转换技术有利于节能减排、保护环境 |
| C、用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| D、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、15.7g混合物未与盐酸完全反应 |
| D、盐酸的物质的量浓度为3.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.48L | B、5.6L |
| C、6.72L | D、7.84L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com