
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑥ | ② | |||||
| 三 | ③ | ⑤ | ④ | ⑩ | ⑦ | ⑧ | ||
| 四 | ⑨ |
 ;
;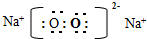 ;
;分析 由元素在周期表中位置,可知①为N、②为F、③为Na、④为P、⑤为Al、⑥为O、⑦为Cl、⑧为Ar、⑨为K、⑩为S,
(1)稀有气体元素最外层达到稳定结构,化学性质最不活泼;
(2)地壳中含量最高的金属元素为Al;元素⑥③以原子个数比1:1形成化合物为过氧化钠,过氧化钠为离子化合物,据此写出其电子式;
(3)非金属性越强,最高价氧化物对应的水化物越强,F、O没有最高正价,则酸性最强的为高氯酸;金属性最强的K,则碱性最强的为KOH;
(4)非金属性越强,对应离子的还原性越弱.
解答 解:由元素在周期表中位置,可知①为N、②为F、③为Na、④为P、⑤为Al、⑥为O、⑦为Cl、⑧为Ar、⑨为K、⑩为S,
(1)Ar为稀有气体原子,最外层达到8电子稳定结构,其化学性质最稳定,Ar的原子结构示意图为: ,
,
故答案为: ;
;
(2)地壳中含量最高的金属元素为Al;元素⑥③以原子个数比1:1形成化合物为过氧化钠,过氧化钠的电子式为: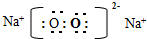 ,
,
f故答案为:Al;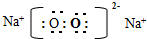 ;
;
(3)这些元素中的最高价氧化物对应的水化物中,非金属性越强,酸性越强,金属性越强,碱性越强,由于F、O元素没有最高正价,则酸性最强的是HClO4;K的金属性最强,则碱性最强的是KOH,
故答案为:HClO4,KOH;
(4)②⑦⑩分别为F、Cl、S元素,非金属性越强,对应离子的还原性越弱,则对应离子还原性由强到弱的次序为:S2- Cl- F-,
故答案为:S2- Cl- F-.
点评 本题考查了元素周期表和元素周期律的综合应用,题目难度中等,明确元素周期表结构、元素周期律内容为解答关键,试题培养了学生的分析能力及灵活应用基础知识的能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
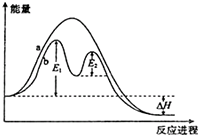
| A. | 反应过程a有催化剂参与 | |
| B. | 改变催化剂,可改变该反应的活化能 | |
| C. | 该反应为吸热反应,热效应等于△H | |
| D. | 加入催化剂,可以提升反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NH3溶解度比I2的溶解度大 | NH3是极性分子,I2是非极性分子 |
| B | 通常条件下,HCl比HI稳定性高 | 非金属性:Cl>I |
| C | NH2OH中N的化合价为:-3 | 电负性:Cl>N |
| D | 沸点:SiO2>CO2 | 式量:SiO2>CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往95%酒精中加入无水氯化钙,蒸馏得到无水乙醇 | |
| B. | 往2mL 10% CuSO4 溶液中滴加几滴2% NaOH,然后滴加少量乙醛,加热制得砖红色沉淀Cu2O | |
| C. | 用氯气和乙烷按1:1体积比混合,光照条件下,制纯一氯乙烷 | |
| D. | 往装有电石的烧瓶中逐滴滴加饱和食盐水,制粗乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:HClO>H2SO3>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,温度计水银球的位置应插入烧瓶的溶液中 | |
| B. | 配制溶液时,摇匀后发现液面低于刻度,加少量水至溶液凹液面恰好与刻度线相切 | |
| C. | 容量瓶用蒸馏水清洗后应烘干后使用 | |
| D. | 实验室制取蒸馏水时,冷凝管水流方向应从下到上,与蒸汽流动方向相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大SO2的转化率K值一定增大 | B. | 减小压强K值减小 | ||
| C. | K值越大SO2转化率越大 | D. | 升高温度K值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com