
| 生成物浓度幂的乘积 |
| 反应物浓度幂的乘积 |
| △c |
| △t |
| [SO3]2 |
| [SO2]2[O2] |
| [SO3]2 |
| [SO2]2[O2] |
| ||
| 5min |
| 1 |
| 3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
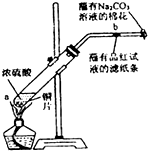 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.反应一段时间后,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.反应一段时间后,停止加热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
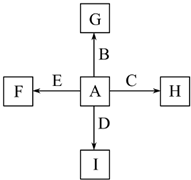 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:| 高温 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
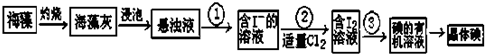
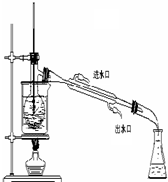
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
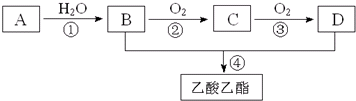
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HNO3在反应中既表现氧化性也表现出酸性 |
| B、每生成22.4L NO(标准状况)有3mol电子转移 |
| C、HNO3作氧化剂,铜作还原剂,3mol Cu还原8mol的HNO3 |
| D、HNO3作氧化剂,铜作还原剂,3mol Cu还原2mol的HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往酸性KMnO4溶液中通入SO2验证SO2的还原性 |
| B、加热氯化铵与氢氧化钙固体混合物制取氨气 |
| C、用二氧化锰和稀盐酸反应制取氯气 |
| D、在溴水、碘水中加入四氯化碳以萃取其中的溴、碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、充电时,阳极附近溶液由蓝色逐渐变为黄色 |
| B、放电过程中,正极附近溶液的酸性减弱 |
| C、充电时,反应每生成2mol H+时电子转移数为2mol |
| D、放电时,负极反应为V2+-e-=V3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白磷和红磷 |
| B、23Na和22Na |
| C、葡萄糖和蔗糖 |
| D、CH3CH(CH3)CH3和CH3CH2CH2CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com