
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大压强 | D. | 增加浓度 |
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属性比硫强 | B. | 最高价氧化物的化学式是SeO2 | ||
| C. | 酸性:H2SeO4>H2SO4 | D. | 气态氢化物的化学式为H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8a g | B. | 0.0745b g | C. | 0.0376c g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | B. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
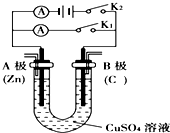 请按要求回答下列问题.
请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
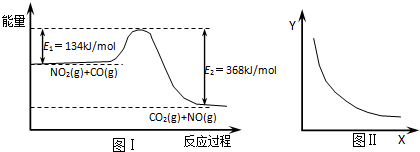
| A. | 该反应的焓变△H=234kJ/mol | |
| B. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| C. | 若X表示反应时间,则Y表示的可能是混合气体的密度 | |
| D. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大多数化学反应在一定条件下都有一定的限度 | |
| B. | 化学反应在一定条件下达到限度时,正、逆反应速率都等于零 | |
| C. | 当某反应体系中气体压强不在改变时,该反应一定达到了反应限度 | |
| D. | 当某反应在一定条件下达到反应限度时,反应物和生成物的浓度一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com