
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH3CH(OH)CH3 | D. | CH3CH2COOH |
分析 醇发生催化氧化的结构特点为:与-OH相连的碳原子上有氢原子;醇能发生消去反应结构特点:与-OH相连的碳原子的邻位碳原子上必须有氢原子,生成物中存在同分异构体,说明消去位置不同,生成物不同,醇类去氢氧化规律:与-OH相连的C上必须有H,伯醇氧化成醛,仲醇氧化得酮,叔醇不能被氧化,据此结合选项解答.
解答 解:1-丙醇结构简式为CH3CH2CH2OH,1-丙醇在铜的催化作用下被氧化的产物为,CH3CH2CHO,
A、与之是同分异构体的是丙酮,结构简式为:CH3COCH3,故A正确;
B、CH3CH2CHO是l-丙醇的氧化产物,故B错误;
C、CH3CHOHCH3为2-丙醇,分子式和氧化产物不同,不是氧化产物的同分异构体,故C错误;
D、CH3CH2COOH为丙酸,分子式和氧化产物的分子式不同,不是同分异构体,故D错误;
故选A.
点评 本题考查醇的催化氧化和消去反应、同分异构体,难度不大,注意醇能发生消去反应结构特点:与-OH相连的碳原子的邻位碳原子上必须有氢原子.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
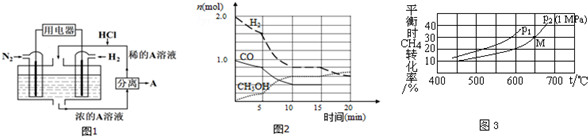
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水保存在棕色剂瓶中,碘保存在配有铁盖的试剂瓶中 | |
| B. | 在配制和贮存FeCl3溶液时,要加入少量铁粉,以防在空气中变质 | |
| C. | 烧碱、纯碱等碱性溶液应保存在配有玻璃塞的试剂瓶中 | |
| D. | 漂白粉、烧碱、Na2SiO3均要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
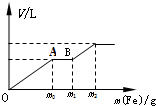 往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示
往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示查看答案和解析>>
科目:高中化学 来源: 题型:实验题
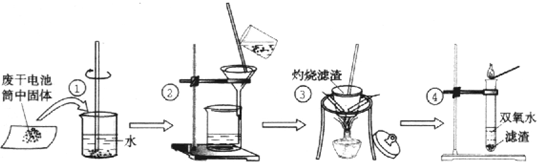
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 群众向高处转移 | |
| B. | 用沾NaOH溶液的湿毛巾捂住口鼻 | |
| C. | 用高压水枪向空中喷洒含碱性物质的水溶液可解毒 | |
| D. | 用沾Na2CO3溶液的湿毛巾捂住口鼻 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com