
 近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霜天气的主要原因之一.冋答下列问题:
近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霜天气的主要原因之一.冋答下列问题: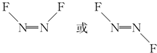 ,1mol N2F2分子中所含有σ键的数目是3NA(填字母)
,1mol N2F2分子中所含有σ键的数目是3NA(填字母)分析 (1)基态O原子核外电子排布式为1s22s22p4,核外没有运动状态相同的电子;
(2)Zn原子核外电子数为30,根据能量最低原理书写其核外电子排布式;
(3)(NH4)2SO4中铵根离子与硫酸根之间形成离子键,硫酸根离子中存在共价键,而铵根离子中含有共价键、配位键;
(4)N和F能形成化合物N2F2,由8电子结构可知结构式为F-N=N-F,N原子杂化轨道数目为3,存在顺反异构,单键为σ键,双键含有1个σ键、1个π键;
(5)a.N2O与CO2是等电子体,结构相似;
b.同一周期元素的第一电离能随着原子序数的增大而呈增大趋势,而ⅡA族、ⅤA族的第一电离能大于同周期相邻元素的;
c.原子数目相等、价电子总数也相等的微粒互为等电子体;
d.HCOOH分子间能形成氢键,CH3OCH3不能形成分子间氢键;
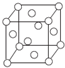
(6)根据均摊法计算晶胞中85Kr原子数目,设晶体中与每个85Kr原子相紧邻的85Kr原子有n个,以顶点原子研究,与紧邻的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故n=$\frac{8×3}{2}$=12;
结合晶胞中具有原子数目,用阿伏伽德罗常数表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)基态O原子核外电子排布式为1s22s22p4,核外没有运动状态相同的电子,即核外电子运动状态有8种,s能级电子云为球形,p能级电子云为哑铃形,
故答案为:8;2;
(2)Zn原子核外电子数为30,其核外电子排布式为:1s22s22p63s23p63d104s2,
故答案为:1s22s22p63s23p63d104s2;
(3)(NH4)2SO4中铵根离子与硫酸根之间形成离子键,硫酸根离子中存在共价键,而铵根离子中含有共价键、配位键,
故答案为:离子键、共价键、配位键
(4)N和F能形成化合物N2F2,由8电子结构可知结构式为F-N=N-F,N原子杂化轨道数目为3,N原子采取sp2杂化,其中一种结构式为: ,单键为σ键,双键含有1个σ键、1个π键,故1mol N2F2分子中所含有σ键的数目是3NA,
,单键为σ键,双键含有1个σ键、1个π键,故1mol N2F2分子中所含有σ键的数目是3NA,
故答案为:sp2; ;3NA;
;3NA;
(5)a.N2O与CO2是等电子体,结构相似,故N2O是直线形结构,故a正确;
b.同一周期元素的第一电离能随着原子序数的增大而呈增大趋势,而ⅡA族、ⅤA族的第一电离能大于同周期相邻元素的,故第一电离能N>O>C,故b错误;
c.O3与SO2、NO2-中原子数目均为3、价电子总数均为18,三者互为等电子体,故c正确;
d.HCOOH分子间能形成氢键,CH3OCH3不能形成分子间氢键,是导致HCOOH的沸点比CH3OCH3的高的主要原因,故d错误.
故选:ac;
(6)设晶胞中所含85Kr原子数为m,根据均摊法可知m=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,设晶体中与每个85Kr原子相紧邻的85Kr原子有n个,以顶点原子研究,与紧邻的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故n=$\frac{8×3}{2}$=12,则$\frac{m}{n}$=$\frac{1}{3}$,
晶胞质量=4×$\frac{85g/mol}{{N}_{A}mo{l}^{-1}}$,晶胞的边长为a nm,则85Kr晶体的密度为 4×$\frac{85g/mol}{{N}_{A}mo{l}^{-1}}$÷(a×10-7 cm)3=$\frac{3.4×1{0}^{23}}{{a}^{3}{N}_{A}}$g.cm-3,
故答案为:$\frac{1}{3}$;$\frac{3.4×1{0}^{23}}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键、等电子体、分子结构与性质、电离能、晶胞计算等,是对物质结构主干知识的综合考查,需要学生具备扎实的基础.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol•L-1 NaCl溶液 | B. | 75mL 2mol•L-1 NH4Cl溶液 | ||
| C. | 50mL 3mol•L-1KClO3溶液 | D. | 50mL 1mol•L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;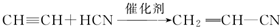 ;
;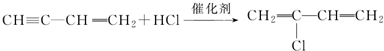 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 2:7 | C. | 1:2 | D. | 8:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
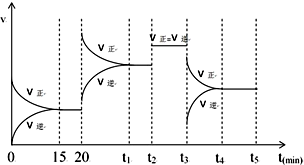 汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:| 化学键 | N≡N键 | O=O键 | N$\stackrel{←}{=}$O键 |
| 键能kJ/•mol-1 | 945 | 498 | 630 |
| 0min | 5min | 10min | 15min | 20min | |
| c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X的分子式为 C12H16O3 | |
| B. | X在核磁共振氢谱图中共出现8组峰 | |
| C. | X在一定条件下能发生加成、加聚、取代、氧化等反应 | |
| D. | 在Ni作催化剂的条件下,1mol X 最多只能与5molH2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com