


科目:高中化学 来源:2012-2013学年广东省高三第三次模拟考试理综化学试卷(解析版) 题型:实验题
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:
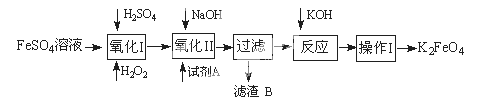
查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定
②溶解度很大,难溶于无水乙醇等有机溶剂
③具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液
回答下列问题:
(1)写出“氧化I”中,生成Fe3+的离子反应方程式 。
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaClO”);过滤操作中,得到的滤渣B中除NaCl还有
(3)操作I中包括冷却结晶、过滤、洗涤干燥几个步骤。洗涤干燥的目的是脱碱脱水,进行该操作时最好用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4 + H2O = Fe(OH)3↓ + KOH +
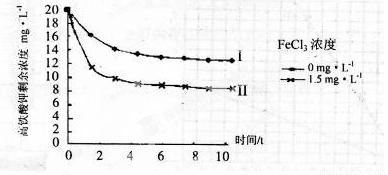
(5)将一定量的K2FeO4投入一定浓度的FeCl3溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com