
 为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
(2)①从表中数据可以看出,温度升高,K值减小,即温度升高时平衡逆向移动;
②起始时,CO和H2的物质的量浓度分别为1 mol/L和3 mol/L,CO的平衡浓度为0.2 mol/L,计算CO浓度变化量,CO转化率=$\frac{CO浓度变化量}{CO起始浓度}$×100%;利用三段式计算平衡时各物质的浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,进而判断温度;
(3)该燃料电池中,甲醇发生氧化反应生成CO2和H2O,CO2与OH-反应生成CO32-与水.
解答 解:(1)已知:①CO(g)+H2O(g)═H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)═CH4(g)△H=-73kJ•mol-1
③2CO(g)═C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,由③-①×2+②得:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-171 kJ•mol-1-(-41 kJ•mol-1)×2-73 kJ•mol-1=-162 kJ•mol-1,
故反应热化学方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1;
(2)①从表中数据可以看出,温度升高,K值减小,即温度升高时平衡逆向移动,所以该反应是放热反应,△H<0,
故答案为:<;
②起始时,CO和H2的物质的量浓度分别为$\frac{2mol}{2L}$=1 mol/L和$\frac{6mol}{2L}$=3 mol/L,CO的平衡浓度为0.2 mol/L,则CO的转化浓度为0.8 mol/L,CO转化率为$\frac{0.8}{1}$×100%=80%;
CO(g)+2H2(g)?CH3OH(g)
起始(mol/L):1 3 0
转化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.2 1.4 0.8
则该温度下,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.8}{0.2×1.{4}^{2}}$=2.041,对应的温度是250℃,
故答案为:80%;250℃;
(3)该燃料电池中,甲醇发生氧化反应生成CO2和H2O,CO2与OH-反应生成CO32-与水,电池总反应离子方程式为:2CH3OH+3O2+4OH-═2CO32-+6H2O,
故答案为:2CH3OH+3O2+4OH-═2CO32-+6H2O.
点评 本题属于拼合型题目,涉及热化学方程式书写、平衡常数影响因素及计算、化学平衡计算、电池反应式书写等,侧重考查学生对知识的迁移应用,掌握利用盖斯定律书写热化学方程式与反应热有关计算,难度中等.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:解答题
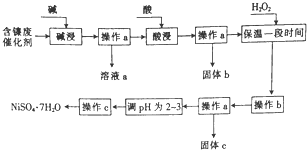 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| FE(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
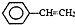 ),聚苯乙烯的化学式为
),聚苯乙烯的化学式为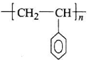
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
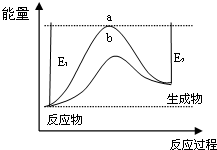
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第5周期第IA族 | B. | 第4周期第IA族 | C. | 第3周期第IA族 | D. | 第3周期第IA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚二氧化碳塑料是通过加聚反应制得的 | |
| B. | 聚二氧化碳塑料与干冰互为同素异形体 | |
| C. | 聚二氧化碳塑料与干冰都属于纯净物 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol•L-1 Na2S溶液中存在:c(OH-)=c(H+ )+c(HS-)+c(H2S) | |
| B. | PH=3的醋酸溶液中:c(H+ )=c(CH3COO-)=0.3mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH- )=1×10-a mol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+ )>c(OH- ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com