
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:分析 (1)等电子体为原子数相同且价电子数相同的原子团,据此答题;
(2)SiO2为原子晶体,熔沸点取决于共价键键能;Na2O为离子晶体,熔沸点取决于其晶格能;P2O5为分子晶体,熔沸点取决于分子间作用力,据此答题;
(3)同主族元素从上到下,原子半径越来越大,原子核对核外电子的吸引力越来越弱,第一电离能逐渐减小,据此答题;
(4)Se原子序数为34,根据能量最低原则、泡利不相容原理和洪特规则写出核外电子的排布式;
(5)SO32-离子价电子对数为$\frac{6+2}{2}$=4,形成4条新的杂化轨道,据此判断杂化方式,并据此判断立体构型;
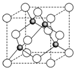
(6)根据晶胞结构图利用均摊法计算出晶胞中所含原子数,并确定化学式.
解答 解:(1)等电子体为原子数相同且价电子数相同的原子团,可以根据S与O同主族想到,CS2;根据同周期相邻元素想到N2O,
故答案为:CS2或N2O;
(2)SiO2为原子晶体,熔沸点取决于共价键键能,熔沸点很高;Na2O为离子晶体,熔沸点取决于其晶格能,熔沸点较高;P2O5为分子晶体,熔沸点取决于分子间作用力,熔沸点较低,
故答案为:SiO2>Na2O>P2O5;
(3)同主族元素从上到下,原子半径越来越大,原子核对核外电子的吸引力越来越弱,第一电离能逐渐减小,
故答案为:O>S>Se;
(4)Se原子序数为34,根据能量最低原则、泡利不相容原理和洪特规则写出为[Ar]3d104s24p4,
故答案为:[Ar]3d104s24p4 ;
(5))SO32-离子价电子对数为$\frac{6+2}{2}$=4,形成4条新的杂化轨道,采用了sp3杂化;孤电子对数=价电子对数-配位原子数=4-3=1,含有一对孤对电子,占据一条杂化轨道,对S-O键有排斥作用,S与O构成三角锥形,
故答案为:sp3;三角锥;
(6)在晶胞结构中,黑颜色球代表的微粒位于体内,共4个;白颜色球代表的微粒8个位于顶点和6个位于面心,个数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,化学式可写为AO,
故答案为:AO.
点评 本题综合考查物质结构与性质,涉及核外电子排布规律、电离能、杂化理论、分子结构、晶胞结构等,其中判断空间构型容易出错,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol/LNaHCO3溶液中通入CO2:c(Na+)=c(HCO3-)+c(CO32-) | |
| B. | 0.10mol/LNaF溶液中通入HCl:c(Na+)>c(HF)=c(Cl-) | |
| C. | 0.10mol/LNa2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol/LNaHSO3溶液通入NH3:c(Na+)>c(NH4+)>c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合理开发利用可燃冰可缓解能源紧缺 | |
| B. | 用食醋可除去热水壶内壁的水垢 | |
| C. | 明矾可用于自来水的消毒、杀菌 | |
| D. | 船舶外壳装上锌块可以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| B. | 室温下,31g白磷分子中含有共价键数目为4NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| D. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 实验室用NH4Cl和Ca(OH)2制备NH3涉及氧化还原反应 | |
| D. | 将分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com