
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
分析 (1)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰;
(2)根据在化合物中正负化合价代数和为零,结合碘酸碘的化学式进行解答本题;
(3)若IOH是两性化合物,IOH的酸式电离生成次碘酸根离子和氢离子;
(4)正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量;
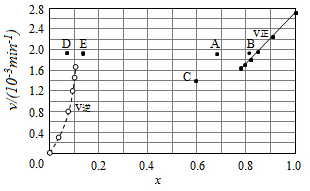
(5)①表中第一列,由HI分解建立平衡,表中第二列向逆反应进行建立平衡,由第一列数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸汽总物质的量分数为1-0.784=0.216,而氢气、与碘蒸汽物质的量分数相等均为0.108,反应前后气体体积不变,用物质的量分数代替浓度代入平衡常数表达式K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$计算;
②到达平衡时,正、逆反应速率相等,结合平衡常数表达式,可知k逆的表达式;
③升高温度,正、逆反应速率均加快,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,正反应建立平衡,平衡时HI的物质的量分数减小,逆反应建立平衡,平衡时H2的物质的量分数增大.
解答 解:(1)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰,反应的离子方程式为:2I-+MnO2+4H+=Mn2++I2+2H2O,
故答案为:2I-+MnO2+4H+=Mn2++I2+2H2O;
(2)由题意,碘和氯有相似的化学性质,则碘酸根中碘元素的化合价与氯酸根中氯元素的化合价相同;氯酸钾中钾元素显+1价,氯酸根的化合价为-1价,则碘酸根的化合价也为-1价;设氯酸根中氯元素的化合价是x,则x+(-2)×3=-1,x=+5价;因此碘酸根(IO3)中碘元素化合价也为+5价;
碘酸根(IO3)显-1价,设I(IO3)3中碘元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:y+(-1)×3=0,则y=+3价.
这种化合物中碘的化合价分别是+3和+5价.
故答案为:CD;
(3)若IOH是两性化合物,IOH的酸式电离生成次碘酸根离子和氢离子,电离方程式为:IOH?H++IO-,
故答案为:IOH?H++IO-;
(4)设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,
故答案为:299;
(5)①表中第一列,由HI分解建立平衡,表中第二列向逆反应进行建立平衡,由第一列数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸汽总物质的量分数为1-0.784=0.216,而氢气、与碘蒸汽物质的量分数相等均为0.108,反应前后气体体积不变,用物质的量分数代替浓度计算平衡常数,则平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=$\frac{0.108×0.108}{0.78{4}^{2}}$,
故答案为:$\frac{0.108×0.108}{0.78{4}^{2}}$;
②到达平衡时,正、逆反应速率相等,则k正x2(HI)=k逆x(H2)x(I2),则k逆=k正×$\frac{{x}^{2}(HI)}{x({H}_{2})x({I}_{2})}$=$\frac{{K}_{正}}{K}$,
故答案为:$\frac{{K}_{正}}{K}$;
③对于2HI(g)?H2(g)+I2(g)反应建立平衡时:
升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;
对于H2(g)+I2(g)?2HI(g)反应建立平衡时:
升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;
因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,
故答案为:A;E.
点评 本题比较综合,涉及考查氧化还原反应、反应热计算、化学平衡常数计算、化学反应速率计算及影响因素、平衡移动等,属于拼合型题目,侧重考查学生自学能力、分析解决问题的能力,注意表中数据为不同方向建立的平衡,题目中没有明确,增大题目难度,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用中和滴定法测定某盐酸的物质的量浓度.
用中和滴定法测定某盐酸的物质的量浓度.| 滴定次数 | 待测液体体积/mL | 标准碱液 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| ① | 20.0 | 0.40 | 20.41 |
| ② | 20.0 | 0.10 | 20.60 |
| ③ | 20.0 | 4.00 | 23.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
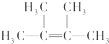 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯.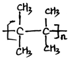 .
. 、(CH3CH2)2C=CH2(包括顺反异构).
、(CH3CH2)2C=CH2(包括顺反异构).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加离子反应的一定都是电解质 | |
| B. | 任何一种离子的浓度在离子反应中一定变小 | |
| C. | 自由离子之间的反应不能在固态中进行 | |
| D. | 没有沉淀、气体、水生成的反应就不是离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氢气分子所占的体积为22.4L | B. | 2NA个二氧化碳分子的质量为44g | ||
| C. | 32g O2所含的氧原子数目是2NA | D. | 17g氨气中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48g O2中含氧原子数为3NA | |
| B. | 标准状况下,22.4 L H2O中所含原子数为3NA | |
| C. | 1 mol/L的K2SO4溶液中,含2 NA个K+ | |
| D. | 24g Mg变为Mg2+时失去的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可以区分淀粉溶胶和肥皂水 | |
| B. | 1L1 mol•L-1Fe(OH)3胶体中,胶粒数目小于NA | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| D. | Fe(OH)3胶体的电泳实验说明了胶体带有电荷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com