
| 选项 | 要鉴别的物质组 | 试剂 | 方法 |
| A | NaCl/Na2CO3 | BaCl2溶液 | 观察是否产生沉淀 |
| B | NO2/Br2 | 湿润的淀粉碘化钾试纸 | 观察试纸是否变蓝色 |
| C | 乙醇/乙酸 | 新制氢氧化铜悬浊液 | 观察溶液是否变澄清 |
| D | CO2/SO2 | 品红溶液 | 观察溶液红色是否退去 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化钠不与氯化钡反应,碳酸钠能够与氯化钡溶液反应生成碳酸钡沉淀;
B.二氧化氮和溴单质都具有氧化性,都能够使湿润的淀粉碘化钾试纸变蓝;
C.乙酸能够与氢氧化铜反应,使浊液变澄清;
D.二氧化硫具有漂白性,能够使品红溶液褪色.
解答 解:A.鉴别NaCl和Na2CO3,可用BaCl2溶液,前者无明显现象,后者生成白色沉淀,故A正确;
B.NO2、Br2都能够使湿润的淀粉碘化钾试纸变蓝,不能用湿润的淀粉碘化钾试纸检验二氧化氮和溴,故B错误;
C.乙醇不与氢氧化铜浊液反应,而乙酸与氢氧化铜反应,从而使氢氧化铜浊液变澄清,可用新制氢氧化铜浊液检验乙醇和乙酸,故C正确;
D.鉴别CO2、SO2,可用品红溶液,前者无明显现象,后者具有漂白性,能够使品红溶液褪色,故D正确;
故选B.
点评 本题考查了性质方案设计与评价,题目难度中等,明确常见物质性质及检验方法为解答关键,注意熟练掌握常见元素及其化合物性质,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,表示的分子式C6H14名称是2-甲基戊烷
,表示的分子式C6H14名称是2-甲基戊烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42- | |
| B. | 用加热法可除去NaHCO3中少量的Na2CO3 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
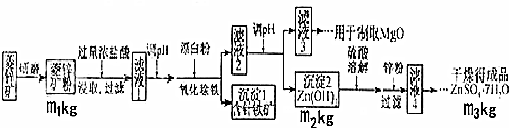
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
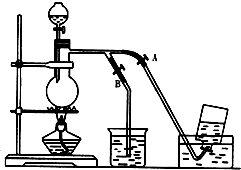
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com