
| A. | 使甲基橙变红色的溶液:Mg2+、Fe2+、SO42-、NO3- | |
| B. | 弱碱性溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 使石蕊显紫色的溶液:Al3+、K+、SO42-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- |
分析 A.使甲基橙变红色的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子;
B.碳酸氢根离子的溶液为弱碱性溶液,四种离子之间不反应;
C.使石蕊显紫色的溶液中存在大量氢氧根离子,铝离子与碳酸氢根离子能够发生双水解反应,且铝离子和碳酸氢根离子都能够与氢氧根离子反应;
D.偏铝酸钠能够与氢离子反应,在溶液中不能共存.
解答 解:A.使甲基橙变红色的溶液为酸性溶液,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.弱碱性溶液中,氢氧根离子浓度较小,Na+、Ca2+、HCO3-、NO3-之间不发生反应,能够存在于弱碱性溶液中,故B正确;
C.使石蕊显紫色的溶液为碱性溶液,溶液中存在大量氢氧根离子,Al3+、HCO3-之间发生双水解反应,Al3+、HCO3-都能够与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.AlO2-、H+之间发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题
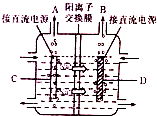 氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.
氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可催熟水果 | |
| B. | SO2、CO2和NO2都可形成酸雨 | |
| C. | 盐析可提纯蛋白质并保持其生理活性 | |
| D. | 通过石油的裂解可获得乙烯、丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | 苯的结构简式:C6H6 | ||
| C. | 硅的原子结构示意图: | D. | Na2S的电子式: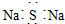 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
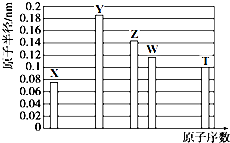
| A. | Z、T两种元素的离子半径相比,前者较大 | |
| B. | X、Y形成的两种化合物中,阴、阳离子物质的量之比分别为1:1和1:2 | |
| C. | X、W、T三种元素的气态氢化物中,稳定性最差的是W的氢化物,沸点最高的是T的氢化物 | |
| D. | Y、T两种元素的最高价氧化物对应的水化物均能溶解X和Z形成的常见化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y |
| W | Z |
| A. | 若X、Y、Z、W中只有一种为金属元素,则W一定为铝元素 | |
| B. | 若W的核电荷数是Y的两倍,则W的氧化物可作半导体材料 | |
| C. | 若Z的核电荷数是Y的两倍,则X的氢化物水溶液显酸性 | |
| D. | 若Y、W的简单阴离子都能破坏水的电离,则Z的简单阴离子也一定能破坏水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①③④ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
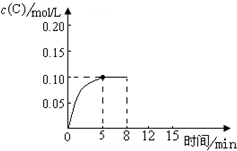 在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com