
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| P-P0 |
| P0 |
| P |
| P0 |
| 9.53-4.91 |
| 4.91 |
| [B]?[C] |
| [A] |
| (0.0941mol/L)2 |
| 0.10×(1-94.1%) |
| [B]?[C] |
| [A] |
| (0.0941mol/L)2 |
| 0.10×(1-94.1%) |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
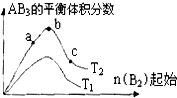 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )| A、达到平衡时A2的转化率大小为:c>b>a |
| B、a、b、c三点的平衡常数相同 |
| C、该反应一定是放热反应,且T2<T1 |
| D、b点时,平衡体系中A、B原子数之比一定是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=3的盐酸与pH=11的氨水溶液中水的电离程度相同 |
| B、滴定相同体积和物质的量浓度的盐酸和醋酸,消耗一定物质的量浓度的烧碱溶液的体积相同 |
| C、0.1 mol/L的Na2CO3溶液和0.01 mol/LNaHCO3溶液中离子种类相同,而且都满足关系式:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
| D、常温下,pH值之和为14的醋酸和NaOH溶液,等体积混合后,溶液pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度有利于反应速率增加,从而缩短达到平衡的时间升高温度 |
| B、正向反应速率增加,逆向反应速率减小 |
| C、达到平衡后,升高温度,平衡向正反应方向移动 |
| D、达到平衡后,减小压强,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、放电时,电池是将化学能转化为电能 |
| B、放电时,正极反应式:LiFeSiO4+Li++e-═Li2SiO4 |
| C、充电时,毎生成1molLiFeSiO4转移2mol电子 |
| D、充电时,Li+向阴极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用NaOH溶液除去金属铝表面的氧化膜的 |
| B、NaCl溶液与CH3COONH4溶液均呈中性,说明两溶液中水的电离程度相同 |
| C、1mol某醇与足量的钠反应生成22.4L氢气(标况下),该醇为二元醇 |
| D、向KI溶液中滴加氯水和CCl4,振荡,静置后溶液出现分层且下层显紫色,证明Cl2氧化性强于I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com