
 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的最外层电子数是最内层电子数的2倍 |
| C元素原子的核外p电子数比s电子数少1 |
| D 原子的第一至第四电离能分别是: I 1=578kJ•mol-1I 2=1817kJ•mol-1 I 3=2745kJ•mol-1I 4=11575kJ•mol-1 |
| E原子核外所有p轨道全满或半满 |
| F元素的主族序数与周期序数的差值为4 |
| G 是前四周期中电负性最小的元素 |
| H在周期表的第12列 |
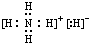 .
. .
.分析 A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;B元素原子的最外层电子数是最内层电子数的2倍,B有2个电子层,最外层电子数为4,故B为碳元素;C元素原子的核外p电子数比s电子数少1,核外电子排布式为1s22s22p3,故C为N元素;由D原子的第一至第四电离能数据可知,第四电离能剧增,处于ⅢA族,原子序数大于N元素,故D为Al;E处于第三周期,E原子核外所有p轨道全满或半满,最外层排布为3s23p3,故E为P元素;F处于第三周期,F元素的主族序数与周期数的差为4,处于第ⅦA族,故F为Cl元素;G是前四周期中电负性最小的元素,G为第四周期元素,故G为K元素,H在第四周期周期表的第12列,G为Zn元素.
解答 解:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;B元素原子的最外层电子数是最内层电子数的2倍,B有2个电子层,最外层电子数为4,故B为碳元素;C元素原子的核外p电子数比s电子数少1,核外电子排布式为1s22s22p3,故C为N元素;由D原子的第一至第四电离能数据可知,第四电离能剧增,处于ⅢA族,原子序数大于N元素,故D为Al;E处于第三周期,E原子核外所有p轨道全满或半满,最外层排布为3s23p3,故E为P元素;F处于第三周期,F元素的主族序数与周期数的差为4,处于第ⅦA族,故F为Cl元素;G是前四周期中电负性最小的元素,G为第四周期元素,故G为K元素,H在第四周期周期表的第12列,G为Zn元素.
(1)已知NH5为离子化合物,其电子式为: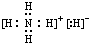 ,
,
故答案为: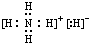 ;
;
(2)A、B、C三种元素可以形成原子个数比为1:1:1的3原子化合物分子为HCN,结构式为H-C≡N,该分子中σ键和π键的个数比为1:1,
故答案为:1:1;
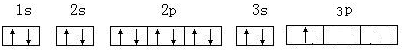
(3)D为Al,基态原子的核外电子排布图: ,
,
故答案为: ;
;
(4)C、A形成最简单化合物为NH3,E与A形成的化合物为PH3,由于NH3分子之间可以形成氢键,沸点较高,
故答案为:NH3分子之间可以形成氢键;
(5)PCl3中P原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,P原子的杂化方式为sp3,其空间构型为三角锥形,
故答案为:sp3;三角锥形;
(6)检验K元素的方法是焰色反应,产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量,
故答案为:焰色反应;当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量;
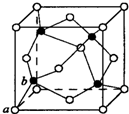
(7)晶胞中Zn、S原子数目均为4,则晶胞质量为4×$\frac{97}{{N}_{A}}$g,其晶胞边长为x pm,则ZnS晶体的密度为 4×$\frac{97}{{N}_{A}}$g÷(x×10-10 cm)3=$\frac{97×4}{{N}_{A}×(x×1{0}^{-10})^{3}}$g•cm-3,
a与b之间连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$ 倍,故a与b之间的距离为$\frac{1}{4}$×$\sqrt{3}$x pm,
故答案为:$\frac{97×4}{{N}_{A}×(x×1{0}^{-10})^{3}}$;$\frac{1}{4}$×$\sqrt{3}$x.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电子式、化学键、氢键、杂化方式与空间构型判断、跃迁、晶胞计算等,(7)中计算为易错点、难点,需要学生具备一定的数学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素的原子核外电子排布呈周期性变化 | |
| B. | 元素主要化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的相对原子质量递增,量变引起质变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②中增大Fe3+浓度使平衡Fe3++3SCN-?Fe(SCN)3正向移动 | |
| B. | 实验③中发生反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 实验③和④中溶液颜色变浅的原因相同 | |
| D. | 实验②、③、④均可说明浓度改变对平衡移动的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的单质可从Z的盐溶液中置换出Z | |
| B. | 简单氮化物的热稳定性:X<W | |
| C. | 简单离子的半径:W>X>Y>Z | |
| D. | X分别与Y、Z形成的化合物中只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2中含有的阴离子数为2 NA | |
| B. | 由H2O2制得2.24 L O2,转移的电子数目为0.4 NA | |
| C. | 常温常压下,8 g O2与O3的混合气体中含有4 NA个电子 | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
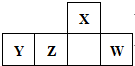 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Y所处的周期数和族序数相等,下列判断错误的是( )
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Y所处的周期数和族序数相等,下列判断错误的是( )| A. | 最简单气态氢化物的热稳定性:X>Z | |
| B. | 最高价氧化物对应水化物的酸性:Z<W | |
| C. | 原子半径:Y>Z>X | |
| D. | 含Y的盐溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
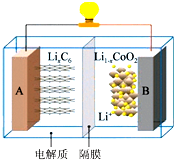 钴酸锂(LiCoO2)电池工作原理如图,A 极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
钴酸锂(LiCoO2)电池工作原理如图,A 极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+由A极区域移向B极区域 | |
| B. | 充电时,A为阴极,发生还原反应C6+xLi++xe-=LixC6 | |
| C. | 放电时,B为正极,电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“充电处理”使锂进入石墨中而有利于回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
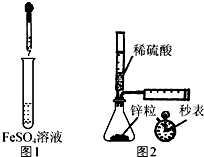
| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤 | |
| D. | 检验淀粉是否水解:取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
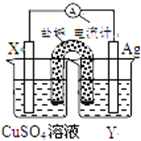 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com