
| A. | 5.6g铁片投入足量浓H2SO4中,转移电子数目为0.3 NA | |
| B. | MnO2与浓盐酸共热,0.4 molHCl被氧化时,转移电子数目为0.4 NA | |
| C. | 高温下,0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
分析 A.铁与浓硫酸常温下发生钝化.
B.根据氯元素的化合价变化来分析;
C.铁与水蒸气反应生成氢气,3mol铁失去8mol电子;
D.在5NH4NO3=2HNO3+4N2+9H2O的反应中,铵根离子中的-3价的氮元素和硝酸根中的+5价的氮元素反应归中反应,均变为0价.
解答 解:A.铁与浓硫酸常温下发生钝化,5.6g铁片投入足量浓H2SO4中,反应程度很小,转移电子数目小于0.3 NA,故A错误;
B.反应后氯元素的化合价由-1价变为0价,故0.4 molHCl被氧化时,转移电子数目为0.4 NA,故B正确;
C.铁与水蒸气反应生成氢气,3mol铁失去8mol电子,则0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA,故C正确;
D.在5NH4NO3=2HNO3+4N2+9H2O的反应中,铵根离子中的-3价的氮元素和部分硝酸根中的+5价的氮元素反应归中反应,均变为0价,此反应转移15mol电子时生成4mol氮气,故当生成28gN2时,转移的电子数目为3.75NA.故D正确;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,注意浓硫酸与铁常温下发生钝化,形成致密的氧化膜阻止反应进行,题目难度中等.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
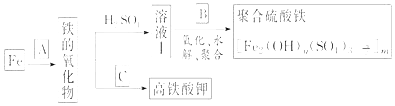
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
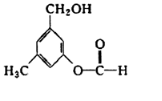 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和FeCl3溶液滴入到NaOH溶液中加热煮沸可制得Fe(OH)3胶体 | |
| B. | 可用Na从TiCl4的水溶液中生产Ti | |
| C. | 工业上利用氯气和石灰水反应生产漂白粉和漂粉精 | |
| D. | 可用石英、石灰石、纯碱在高温下生产玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4:2 | B. | 2:3:3 | C. | 6:3:1 | D. | 2:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 酸 | H2CO3 | CH3COOH | HClO |
| K | K1=4.4×10-7;K 2=4.7×10-11 | K=1.76×10-5 | K=2.95×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
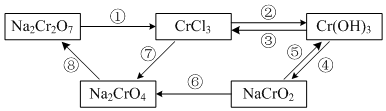
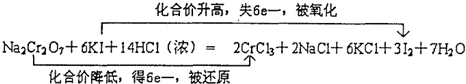
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com