
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | PX项目的主要产品对二甲苯属于饱和烃 |
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
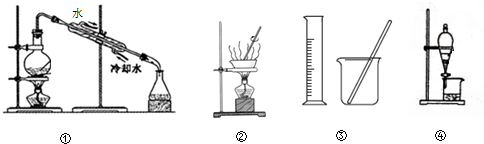
| A. | 用①分离NaCl溶液和NaOH溶液 | |
| B. | 用②蒸干NH4Cl和饱和溶液获取NH4Cl晶体 | |
| C. | 用③配制100mL 0.1000mol•L-1 K2Cr2O2溶液 | |
| D. | 用④分离Na2CO3溶液和CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
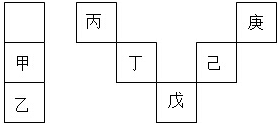
| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
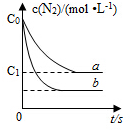 等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),下图曲线a表示该反应在T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),下图曲线a表示该反应在T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | T℃时,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| B. | T℃时,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
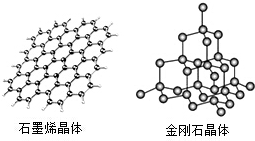 碳及其化合物广泛存在于自然界中,回答下列问题:
碳及其化合物广泛存在于自然界中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
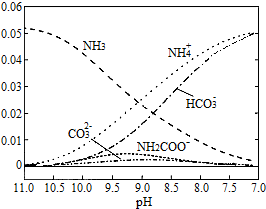
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| D. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com