
【题目】下列说法错误的是( )
A.FeO是碱性氧化物
B.用加热法分离泥沙中的碘单质是化学变化
C.丁达尔效应可用于区分胶体和溶液
D.Fe2O3+3CO ![]() 2Fe+3CO2 是复分解反应
2Fe+3CO2 是复分解反应
【答案】D
【解析】解:A、和酸反应生成盐和水的化合物为碱性氧化物,FeO+2HCl=FeCl2+H2O,符合碱性氧化物概念,故A正确; B、碘单质易升华属于物理变化,用加热法分离泥沙中的碘单质是利用碘单质的升华性质是物理变化,故B错误;
C、丁达尔效应是胶体的性质,溶液无此性质,丁达尔效应可用于区分胶体和溶液,故C正确;
D、复分解反应是两种化合物相互交换成分生成另外两种化合物的反应,反应过程中无元素化合价变化且在水溶液中进行,Fe2O3+3CO ![]() 2Fe+3CO2是氧化还原反应,故D错误;
2Fe+3CO2是氧化还原反应,故D错误;
故选D.
【考点精析】认真审题,首先需要了解物理变化与化学变化的区别与联系(化学变化本质:旧键断裂、新键生成或转移电子等;二者的区别是:前者无新物质生成,仅是物质形态、状态的变化).


科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
(1)氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: . (△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25°C下,将m molL﹣1的氨水与n molL﹣1的盐酸等体积混合,反应后的溶液呈中性,则c(NH+4)c(Cl﹣)(填“>”、“<”或“=”);用含m和n的代数式表示出混合液中氨水的电离平衡常数表达式 .
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.25°C下,向0.1molL﹣1的NaCl溶液中逐滴加入适量的0.1molL﹣1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 , 向反应后的浊液中,继续加入适量0.1molL﹣1的NaI溶液,振荡、静置,看到的现象是 , 产生该现象的原因是(用离子方程式表示) .
(已知25°C时Ksp[AgCl]=1.0×10﹣10mol2L﹣2 , Ksp[AgI]=1.5×10﹣16mol2L﹣2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T是地壳含量最多的金属元素,W所处的周期序数是其原子最外层电子数的一半.
Q | R | ||
T | W |
(1)R的原子结构示意图是 , 用化学方程式表示工业上常用于冶炼T单质的原理是 .
(2)元素的非金属性:QW(填“强于”或“弱于”),简述其原因是 .
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.所有原子的原子核都是由质子和中子构成的
B.氢离子(H ) 实质上是一个裸露的质子
C.核外电子排布相同的微粒, 其化学性质也相同
D.非金属元素原子最外层电子数都大于 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10﹣9 mol/L
B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7
C.在c(H+):c(OH﹣)=1:1012的溶液中,Na+、I﹣、NO ![]() 、SO42﹣能大量共存
、SO42﹣能大量共存
D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO ![]() )+c(SO
)+c(SO ![]() )+c(HCO
)+c(HCO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O42H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下: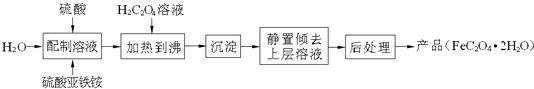
(1)配制(NH4)2Fe(SO4)26H2O溶液时,需加少量硫酸,目的是 .
(2)沉淀时发生反应的化学方程式为 .
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成.这说明草酸亚铁晶体具有(填“氧化”或“还原”)性.若反应中消耗1mol FeC2O42H2O,则参加反应的n(KMnO4)为 .
(4)称取3.60g草酸亚铁晶体(摩尔质量是180gmol﹣1)用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示: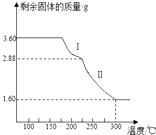
①过程Ⅰ发生反应的化学方程式为 .
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质进行的分类正确的是( )
A.纯碱、烧碱都属于碱
B.结晶硫酸铜(CuSO4·5H2O)属于电解质
C.凡能电离出氢离子的化合物都属于酸
D.盐类物质一定含有金属阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究.
(1)A中铁与浓硫酸发生反应的化学方程式是 , 反应中浓硫酸表现出的性质是 .
(2)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后 , 则证明装置的气密性良好.
(3)装置C的作用 .
(4)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg.铁碳合金中铁的质量分数为(写表达式).
(5)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数会偏低,原因是空气中CO2、H2O进入E管使b增大.你认为改进的方法是 .
(6)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数还会偏高.你认为其中的原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com