
 ,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).
,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).分析 (1)氨气分子为三角锥形;氨气分子与水分子之间形成氢键;
(2)元素非金属性越强,对应氢化物越稳定;
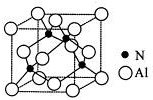
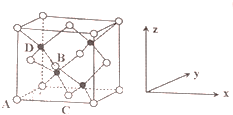
(3)由AlN的晶胞结构可知,一个N原子与距离最近的四个Al原子成键,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,每个N原子都形成1个配位键;以顶点Al原子研究,与之紧邻的铝原子处于面心位置;
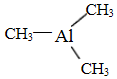
(4)(CH3)3Al为非极性分子,Al原子与3个甲基形成平面正三角形结构;晶胞中晶胞中N原子数目为4、Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮化铝化学式为AlN,可由(CH3)3Al和NH3在一定条件下反应制得,由元素守恒可知还生成甲烷;
(5)等电子体的结构相似,原子总数、价电子总数也相等,将晶胞中Al原子、N原子可以替换为碳原子得到其等电子体;
氮化铝、氮化硅均属于原子晶体,键长越短,共价键越稳定,物质的硬度越大.
解答 解:(1)NH3的空间构型为三角锥形;NH3极易溶于水的主要原因:氨气分子与水分子之间形成氢键,
故答案为:三角锥形;氨气分子与水分子之间形成氢键;
(2)元素非金属性越强,等于氢化物越稳定,由于氧元素非金属性比硅的强,故氢化物稳定性:H2O>SiH4,
故答案为:>;氧元素非金属性比硅的强;
(3)由AlN的晶胞结构可知,一个N原子与距离最近的四个Al原子成键,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,每个N原子都形成1个配位键,图中4 个氮原子共形成4个配位键,氮原子的配位数为4;
以顶点Al原子研究,与之紧邻的铝原子处于面心位置,每个顶点为8个晶胞共用,每个面为2个晶胞共用,故每个铝原子周围紧邻的铝原子数目为$\frac{8×3}{2}$=12,
故答案为:4;4;12;
(4)(CH3)3Al为非极性分子,Al原子与3个甲基形成平面正三角形结构,Al原子采取sp2杂化,
晶胞中晶胞中N原子数目为4、Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮化铝化学式为AlN,可由(CH3)3Al和NH3在一定条件下反应制得,由元素守恒可知还生成甲烷,反应方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与机反应中取代反应类型相似,
故答案为:sp2;(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ;取代反应;
(5)等电子体的结构相似,原子总数、价电子总数也相等,将晶胞中Al原子、N原子可以替换为碳原子得到其等电子体,则其等电子体为金刚石等;
氮化铝、氮化硅均属于原子晶体,由于Si原子半径小于Al的原子半径,故N-Si的键长比N-Al的短,故N-Si键更稳定,氮化硅的硬度更大,
故答案为:金刚石;氮化硅.
点评 本题是对物质结构的考查,涉及元素周期律应用、微粒构型判断、晶胞结构与计算、配位键、等电子体、晶体类型与性质等,题目培养学生分析能力、知识迁移运用能力,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:
次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将经过无害化处理的生活污水排放到漓江中 | |
| B. | 漓江沿岸不得开设造纸厂等污染企业 | |
| C. | 定期投放水生动物优化漓江生态 | |
| D. | 使用含磷洗涤剂且将洗涤后的废水排放到漓江中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
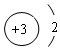 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
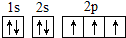 ,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).
,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
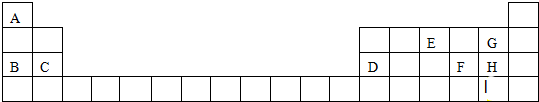
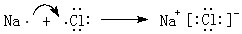 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com