
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:C3H8(g) = CH4(g)+C2H2(g)(乙炔)+H2(g) △H1=+156.6kJ·mol-1
C3H6(g)(丙烯) = CH4(g)+C2H2(g) (乙炔)△H2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)=C3H6(g)(丙烯)+H2(g)的△H= kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程为 ;
放电时,CO32-移向电池的 (填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1= 。
HCO3-+H+的平衡常数K1= 。
(已知:10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是
(用离子方程式和必要的文字说明)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1= CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-, CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
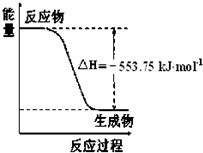 (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com