

分析 A装置:利用碳酸钙与盐酸可以发生复分解反应生成氯化钙、水和二氧化碳的性质,制取二氧化碳,B装置:氯化氢易挥发,制取的二氧化碳中含有氯化氢,通过饱和的碳酸氢钠除去二氧化碳中的氯化氢,C装置:研究Na2O2与干燥CO2是否发生反应,D装置:除去多余的二氧化碳,E装置:收集生成的气体氧气.
(1)实验室通常使用石灰石或大理石(主要成分都为碳酸钙)与稀盐酸反应制取二氧化碳;根据仪器A的特征及常见仪器的名称分析解答;
(2)氯化氢易挥发,制取的二氧化碳中含有氯化氢,通过饱和的碳酸氢钠除去二氧化碳中的氯化氢;
(3)Na2O2与干燥的CO2反应生成碳酸钠和氧气;
(4)根据用排水法收集氧气的方法进行收集操作,根据氧气能支持燃烧确定检验氧气的方法;
(5)水能和过氧化钠反应生成氧气,该实验制取的二氧化碳以及除氯化氢都在溶液中进行,未排除水蒸气的干扰.
解答 解:(1)盐酸的酸性强于碳酸,实验室通常使用石灰石或大理石(主要成分都为碳酸钙)与稀盐酸反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,仪器A具有圆底特征,为圆底烧瓶,盛放固体,所以药品X是石灰石,
故答案为:石灰石;圆底烧瓶;
(2)氯化氢易挥发,制取的二氧化碳中含有氯化氢,由于二氧化与碳酸氢钠不发生反应,而碳酸氢钠能够与氯化氢发生反应,反应的离子方程式为:H++HCO3-=CO2↑+H2O,所以通常用小苏打的饱和溶液除去CO2气体中混有的HCl气体;
故答案为:除去CO2中混有的HCl气体;
(3)装置E有气体生成,说明Na2O2与干燥的CO2反应,反应为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)氧气难溶于水,用排水法收集,在水面下用玻璃片盖住集气瓶口,将集气瓶移出水槽,正放在桌面上,由于氧气能支持燃烧,故检验氧气的方法将带火星的小木条伸入集气瓶,观察是否复燃,
故答案为:在水面下用玻璃片盖住集气瓶口,将集气瓶移出水槽,正放在桌面上,将带火星的小木条伸入集气瓶,观察是否复燃;
(5)过氧化钠和水的反应生成氢氧化钠和氧气,化学方程式:2Na2O2+2H2O=4NaOH+O2↑,该实验制取的二氧化碳以及除氯化氢都在溶液中进行,未排除水蒸气的干扰,所以以上实验不能达到实验目的研究Na2O2与干燥CO2是否发生反应,
故答案为:不能,因为上述实验中的CO2中始终含有水蒸气.
点评 本题考查Na2O2与干燥CO2是否发生反应探究实验,掌握过氧化钠的性质是解答关键,侧重分析能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ①③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝镁合金的硬度较大,钠钾合金常温下为液态 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜溶液中的铜,钠也能置换硫酸铜溶液中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,氧在产物中的化合价都是-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体中含有Na+、Cl-,所以NaCl晶体能导电 | |
| B. | CO2溶于水能导电,所以CO2是电解质 | |
| C. | BaSO4难溶于水,BaSO4是非电解质 | |
| D. | Cl2的水溶液能够导电,但Cl2既不是电解质也不是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成了氢氧化铁沉淀 | |
| B. | 溶液中不存在Fe3+ | |
| C. | 加入少量盐酸,则溶液中Fe3+浓度会减小 | |
| D. | 体系中存在着氢氧化铁的沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
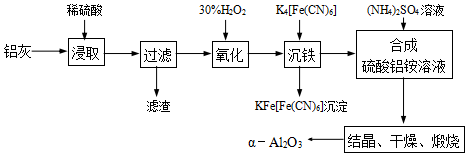

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与氢氧化钾溶液 | B. | 氢氧化铜和盐酸 | ||
| C. | 硫酸氢钠与氨水溶液 | D. | 硝酸与氢氧化钡溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com