
【题目】某钠盐溶液可能含有阴离子 NO![]() 、CO
、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、Br-、I-。为鉴定这些离子,分别取少量溶液进行以下实验:
、Cl-、Br-、I-。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得溶液呈碱性;
②加HCl后,生成无色、无味气体。该气体能使饱和石灰水溶液变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀。
分析上述5个实验,写出每一实验鉴定离子的结论(用“一定有”或“可能有”或“一定没有”来描述,说明理由。)。
(1)实验①_____________________________;
(2)实验②______________________________;
(3)实验③____________________________;
(4)实验④____________________________;
(5)实验⑤____________________________。
【答案】 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性 一定有CO32-,一定没有SO32-,因SO2有刺激性气味 一定没有Br-、I-,因二者均能与氯水反应生成溴单质和碘单质,溴和碘单质溶于CCl4显色 一定有SO42-,因BaSO4不溶于盐酸 可能有Cl-,因为加入硝酸银溶液,可能会产生硫酸银白色沉淀
【解析】(1)实验①:CO![]() 和SO
和SO![]() 均水解显碱性,在碱性环境下可能存在。
均水解显碱性,在碱性环境下可能存在。
(2)实验②:CO![]() 和SO
和SO![]() 均能和强酸反应生成气体二氧化碳和二氧化硫,二氧化硫气体有刺激性气味。
均能和强酸反应生成气体二氧化碳和二氧化硫,二氧化硫气体有刺激性气味。
(3)实验③:氯气能将溴离子和碘离子氧化为碘单质和溴单质,二者在四氯化碳中溶解度很大,并且均是有颜色的。
(4)实验④:向溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解,则一定含有硫酸钡。
(5)实验⑤:溶液中加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀,可能为硫酸银沉淀,不一定为氯化银沉淀。
(1)实验①:测得混合液呈碱性,而CO![]() 和SO
和SO![]() 水解显碱性,所以在碱性环境下可能含有CO32-或者含有SO32-或二者都存在;正确答案: 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性。
水解显碱性,所以在碱性环境下可能含有CO32-或者含有SO32-或二者都存在;正确答案: 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性。
(2)实验②:CO![]() 和SO
和SO![]() 均能和强酸反应生成气体二氧化碳和二氧化硫,但是二氧化硫是有刺激性气味的气体,所以生成无色无味气体是二氧化碳,一定不存在SO
均能和强酸反应生成气体二氧化碳和二氧化硫,但是二氧化硫是有刺激性气味的气体,所以生成无色无味气体是二氧化碳,一定不存在SO![]() 离子,一定有CO
离子,一定有CO![]() 离子;正确答案: 一定有CO32-,一定没有SO32-,因SO2有刺激性气味。
离子;正确答案: 一定有CO32-,一定没有SO32-,因SO2有刺激性气味。
(3)实验③:氯气能将溴离子和碘离子氧化为碘单质和溴单质,二者在四氯化碳中溶解度很大,并且均是有颜色的;正确答案: 一定没有Br-、I-,因二者均能与氯水反应生成溴单质和碘单质,溴和碘单质溶于CCl4显色。
(4)实验④:根据硫酸根离子的检验试剂是氯化钡,可以向溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解,则一定含有硫酸钡;正确答案: 一定有SO42-,因BaSO4不溶于盐酸。
(5)实验⑤:溶液中加HNO3酸化后, 再加过量AgNO3,如果溶液中含有SO42-,Ag+与SO42-也可生成硫酸银白色沉淀,不一定会产生氯化银沉淀,所以不能确定溶液中含有氯离子;正确答案: 可能有Cl-,因为加入硝酸银溶液,可能会产生硫酸银白色沉淀。


科目:高中化学 来源: 题型:
【题目】在空气中,钢铁与食盐水接触,发生吸氧腐蚀,在负极上发生的电极反应是( )
A. Fe-2e-=Fe2+B. 2H++2e-=H2↑
C. Na++e-=NaD. 2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较过氧化氢在四种不同条件下发生分解反应:2H2O2=2H2O+O2↑,其中产生O2的反应速率最大的试验编号是( )
实验编号 | 温度 | 过氧化氢的质量分数 | 催化剂 |
A | 20℃ | 4% | 无 |
B | 50℃ | 4% | 有 |
C | 20℃ | 12% | 无 |
D | 50℃ | 12% | 有 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:

试回答下列问题:
(1)请写出C装置中生成CH2Cl2的化学方程式:_________________________________。
有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法___________(填“正确”或“不正确”)。
(2)B装置有三种功能:①混匀混合气体;②___________;③___________。
(3)D装置的名称为___________,其作用是___________。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为___________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为___________,生成HCl的总物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
【答案】B
【解析】
NO、CO2的混合气体通过足量的Na2O2发生反应有2Na2O2+2CO2═2Na2CO3+O2、2NO+O2═2NO2,问题的关键在于NO与氧气反应存在着三种可能性,一种情况是恰好反应,一种情况是NO过量,另一种情况可能是O2过量,据此讨论计算。
NO、CO2的混合气体通过足量的Na2O2发生反应有(1)2Na2O2+2CO2═2Na2CO3+O2、(2)2NO+O2═2NO2,假设参加反应的CO2为x mL,NO为ymL,则x+y=10,由方程式得以下关系:
①2CO2+ 2Na2O2= 2Na2CO3+ O2
2mL 1mL
xmL ![]() mL
mL
②2NO + O2 = 2NO2
2mL 1mL 2mL
ymL ![]() mL
mL
当反应②恰好反应时,即当y=x时(此时x、y都等于5),生成的NO2的体积为5mL,显然符合题意,A正确;当y>x时,NO有过量,O2反应完,此时反应掉的NO为xmL,则剩余的NO为(ymL-xmL),生成的NO2气体为xmL,因此反应最后得到的混合气体为NO和NO2,其体积和为(ymL-xmL)+xmL=ymL,结合x+y=10,再根据NO过量的前提条件为y>x,可以得出结论y>5,这与题意“气体体积缩小为5mL”不符,B错误;当y<x时,NO不足,O2过量,此时反应掉的O2为![]() mL,剩余的O2为(
mL,剩余的O2为(![]() —
—![]() )mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(
)mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(![]() —
—![]() )mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
)mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
【点睛】
本题考查混合物的有关计算,属于讨论型计算,侧重对综合能力的考查,确定反应可能的情况是解答的关键。
【题型】单选题
【结束】
24
【题目】在一定温度和压强下,将一支容积为21mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升一定高度不再变化时,在相同条件下再通入O2,若要使试管内的液面仍保持在原高度,则通入O2的体积为
A. 8.75mL B. 12.25mL
C. 5.25mL D. 10.5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
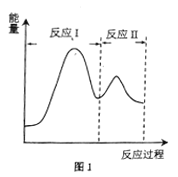
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室从海带灰中提取碘并制备KI晶体。
I.碘单质的提取,实验过程如图:

请回答下列问题
(1)操作b的名称是____________.
(2)试剂a可以选用的是____________.(填序号)
A.苯 B. CCl4 C.甘油 D.直馏汽油 E.己烯
Ⅱ.KI晶体的制备,实验装置如图:

实验步骤如下
i.配制0.5moL的KOH溶液。
i.在三颈瓶中加入12.7g研细的单质I2和250mL0.5mol/L的KOH溶液,搅拌至碘完全溶解。
ⅲ通过滴液漏斗向反应后的溶液中滴加适量甲酸,充分反应后, HCOOH被氧化为CO2,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得KI产品14.5g。
请回答下列问题:
(3)配制0.5mol/LKOH溶液时,下列操作导致配得的溶液浓度偏高的是_________(填序号)。
A.托盘上分别放置质量相等的纸片后称量KOH固体
B.KOH固体样品中混有K2O2
C.称量好的固体放入烧杯中溶解未经冷却直接转移入容量瓶
D.未洗涤烧杯及玻璃棒直接向容量瓶中加水定容
E.定容时仰视刻度线
F.定容后摇匀,液面下降,再加水至刻度线
G.定容后摇匀,少量溶液溅出容量瓶
(4)步骤ⅱ中I2与KOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,请写出氧化产物的化学式:____________.
(5)步骤ⅲ中向溶液中滴加适量甲酸时,需打开活塞______________(填“a”“b”或“a和b”)
(6)实验中,加入 HCOOH发生氧化还原反应的离子方程式为___________________________.
(7)实验中KI的产率为________________%(结果保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com