
A 、B、C、D是四种可溶性化合物,分别由阳离子K+、Ba2+.、Al3+、 Fe3+和阴离子OH—、CO![]() 、NO
、NO![]() 、SO
、SO![]() 两两组合而成,它们的溶液能发生如下反应:
两两组合而成,它们的溶液能发生如下反应:
(1)A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。
(2)C与D反应生成有色沉淀。
(3)B与C反应生成白色沉淀。
写出它们的化学式:
A._________;B._________;C._________;D._________;
科目:高中化学 来源: 题型:
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
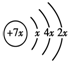 ,B是同周期除稀有气体外半径最大的元素,C的最外层有 三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有 三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:



查看答案和解析>>
科目:高中化学 来源: 题型:
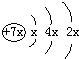 a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族.a的原子结构示意图为,b与c形成的化合物为 b3c,其中b的化合价为+1.下列比较中正确的是( )
a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族.a的原子结构示意图为,b与c形成的化合物为 b3c,其中b的化合价为+1.下列比较中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为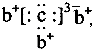 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com