
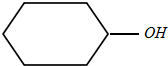
 ),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )
),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )| A. | 68 | B. | 75 | C. | 80 | D. | 87.5 |
分析 环己醇、丙酮、乙醛的分子式分别为C6H12O、C3H6O、C2H4O,分子中C原子与H原子数目之比为1:2,则混合物中C原子与H原子数目之比为1:2,氧原子数目都相等为1,则平均分子组成为CnH2nO,气体通过P2O5吸收瓶,吸收瓶增重1.8g为生成水的质量,根据H元素守恒计算n的值,进而确定平均分子式,计算平均相对分子质量.
解答 解:环己醇、丙酮、乙醛的分子式分别为C6H12O、C3H6O、C2H4O,分子中C原子与H原子数目之比为1:2,则混合物中C原子与H原子数目之比为1:2,氧原子数目都相等为1,则平均分子组成为CnH2nO,气体通过P2O5吸收瓶,吸收瓶增重1.8g为生成水的质量,由化学式知1mol这个混合物燃烧生成x molH2O,
CnH2nO~~~nH2O
1.75g 1.8g
14n+16 18n
所以$\frac{1.75}{14n+16}=\frac{1.8}{18n}$
n=4.57,则
混合物的平均相对分子质量为14n+16=14×4.57+16=80,
故选C.
点评 本题有机物分子式确定、混合物的有关计算,难度中等,确定混合物中碳原子与氢原子数目之比为定比1:2是关键,注意利用平均组成进行解答.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
 +H2O→
+H2O→ (不需注明条件,其他无机试剂任选).
(不需注明条件,其他无机试剂任选). .
. .
.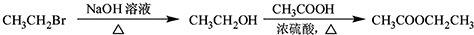
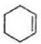 $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$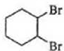 $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$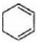 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 3Cu(s)+8HNO3(aq)═3Cu(NO3)2(aq)+2NO(g)+4H2O(l)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
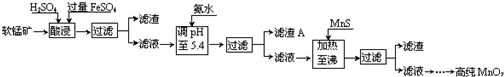
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、Cl-、NO3- | B. | Al3+、Mg2+、SO42-、OH- | ||
| C. | Fe2+、H+、K+、MnO4- | D. | Cu2+、H+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
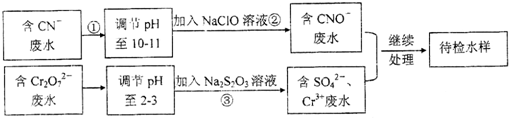
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 为了防止电池中的重金属等污染土壤和水体,应积极开发废电池回收利用技术 | |
| C. | 工业上采用电解熔融氯化铝制取金属铝 | |
| D. | 金属的腐蚀分为化学腐蚀和电化学腐蚀,但二者的本质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3溶液 | B. | BaCl2溶液 | C. | NaAlO2溶液 | D. | Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
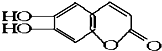 ,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )
,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )| A. | 3mol Br2;2mol NaOH | B. | 3mol Br2;4mol NaOH | ||
| C. | 2mol Br2;3mol NaOH | D. | 4mol Br2;4mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com