
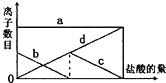
 向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子数目的对应关系,完全正确的是( )
向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子数目的对应关系,完全正确的是( )| A. | a:K+; b:HCO3-;c:CO32-;d:Cl- | B. | a:K+; b:CO32-;c:HCO3-;d:Cl- | ||
| C. | a:K+; b:CO32-;c:Cl-;d:HCO3- | D. | a:K+; b:HCO3-;c:Cl-;d:CO32- |
分析 因考虑K2CO3在溶液中电离出K+和CO32-,盐酸溶液中存在H+、Cl-,因而出现CO32-+H+═HCO3-,然后HCO3-+H+═H2O+CO2,因向一定量的K2CO3溶液中缓慢地滴加稀盐酸,即出现如图现象.
解答 解:向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌,a一直不变,那么a表示的是K+,b逐渐减小,当减小到0时,c又开始减小,b表示的是碳酸根离子,碳酸根离子和氢离子反应生成碳酸氢根离子,当碳酸根离子反应完后,氢离子和碳酸氢根离子反应,所以c表示HCO3-,d从0一直不断地增大,d是Cl-,答案选B..
故选B.
点评 本题考查酸的性质理解运用,涉及离子反应的实质,侧重于推断能力的运用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1]:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
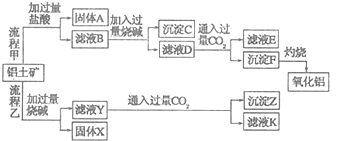
 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
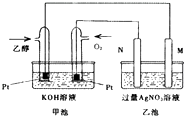 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
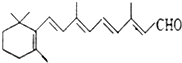 人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )
人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )| A. | 视黄醛的分子式为C20H27O | |
| B. | 视黄醛可以使溴水和酸性高锰酸钾溶液褪色,也能发生银镜反应 | |
| C. | 视黄醛分子结构中含有苯环、碳碳双键和醛基 | |
| D. | 1mol视黄醛在催化剂的作用下最多可与5molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
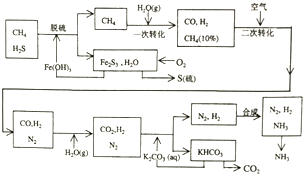
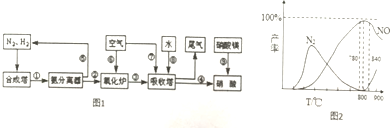
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,乙酸官能团的名称羧基.
,乙酸官能团的名称羧基.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com