
【题目】在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A,B两容器中气体的体积之比是( )
A.1:2
B.2:1
C.1:1
D.无法比较
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),使用的试剂和分离方法都正确的是( )
物质 | 试剂 | 分离方法 | |
① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
③ | 乙醇(水) | 生石灰 | 蒸馏 |
④ | 氯化铵(氯化铁) | 氢氧化钠溶液 | 过滤 |
A.①②B.①③C.只有③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度和压强下,a体积的X2气体和3a体积的Y2气体化合生成2a体积的气体化合物,则该化合物的化学式是( )
A.XY3B.XYC.X3YD.X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol氦气所含原子的数目为2NA
B.12 g 12C中所含的碳原子数为NA
C.标况下22.4 L的任何气体所含原子数均为NA
D.相同体积的O2(g)和NO2(g)分子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的石油化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义,其中一种工艺原理如下:
①C3H8(g)![]() C3H6(g)+H2(g)△H1
C3H6(g)+H2(g)△H1
②C3H8(g)![]() C2H4(g)+CH4(g) △H2=+81.7kJ/mol
C2H4(g)+CH4(g) △H2=+81.7kJ/mol
③C2H4(g)+H2(g)![]() C2H6(g) △H3
C2H6(g) △H3
④C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) △H4=-54.8kJ/mol
CH4(g)+C2H6(g) △H4=-54.8kJ/mol
(1)计算反应③的反应热△H3=______________。
(2)丙烷脱氢平衡常数、丙烷裂解产物选择性与温度关系如图1所示,从图像判断△H2____0,工业生产中采用的温度600-650℃,原因是__________________。
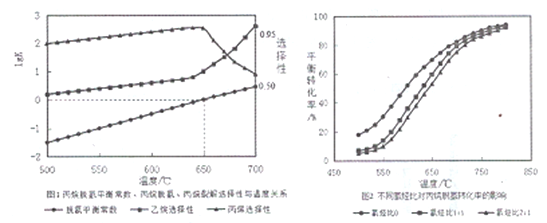
(3)温度为650℃时,在1L的容器中投入1molC3H8和1molH2发生反应①,计算该条件下C3H8理论脱氢率为(保留3位有效数字,下同)_________________(已知: ![]() )
)
(4)不同氢烃比和温度对丙院脱氢平衡转化率的影响如上图2所示。相同温度下,增大氢烃比平衡转化率下降的原因是__________________。
(5)丙烯经过两步氧化可制得丙烯酸(用HR表示,其电离常数Ka=5.55×10-5)。常温下,丙烯酸钠的水解常数为________,将0.2mol/LHR与0.1mol/LNaOH等体积混合,则溶液中的离子浓度大小顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下图所示装置:
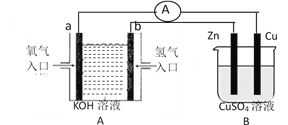
(1)装置A中b的电极名称为________极,a电极反应式为___________________________________;
(2)B装置中Cu为________极,电极反应式为___________________________________;
(3)当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为______________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.1 mol![]() 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)有人称溶液①是油污的“清道夫”,原因是_____________________(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)______________________
(3)向④中加入少量氯化铵固体,此时![]() 的值___________(填“增大”“减小”或“不变”)。
的值___________(填“增大”“减小”或“不变”)。
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3·H2O]=_____________mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:__________________________;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素周期表的一部分,请根据元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是________(用化学式表示,下同);碱性最强的是________。
(2)④、⑤、⑥的简单离子半径由大到小的顺序是________(用离子符号)。
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有:________。
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)________;__________。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A![]() B
B![]() C
C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为______。对应的反应①的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是合成抗生素灰黄霉素的中间产物,其合成路线如下:

已知:
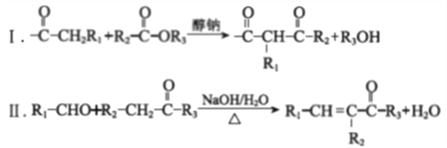
(R1、R2、R3代表烃基或氢原子)
(1)A中含有的官能团的名称为醚键、氯原子、________、________。
(2)A→C反应的化学方程式是________。
(3)C→D的反应类型是________。
(4)E的结构简式是________。
(5)I的核磁共振氢谱中只有一个吸收峰。
①条件a是________。
②H→I反应的化学方程式是________。
③I→K反应的化学方程式是________。
(6)L的结构简式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com