
(10分)实验室要配制480 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有__________________(填选项的字母)。
A.烧杯 B.500 mL容量瓶 C.漏斗 D.胶头滴管 E.玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)取用任意体积的该NaOH溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A.溶液中NaOH的物质的量 B.溶液的浓度
C.溶液中OH-的数目 D.溶液的密度
(4)在配制上述溶液的过程中,下列情况对 NaOH溶液物质的量浓度有何影响(填“偏高”、“偏低”、或“无影响”)
①未经冷却趁热将溶液注入容量瓶中:______________
②容量瓶用蒸馏洗涤后残留有少量的水:_____________
③定容时某同学观察液面的情况如图所示,则所配制的溶液的浓度____________。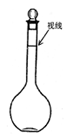
④转移溶液后,未洗涤烧杯和玻璃棒就直接定容___________。(“偏低”、或“无影响”)
(10分)(1)C (2分)
(2)4.0(2分)
(3)BD(2分)
(4)①偏高(1分)
②无影响(1分) ③偏高(1分) ④偏低(1分)
解析试题分析:(1)配制溶液时,需要烧杯溶解固体,用玻璃棒进行搅拌,容量瓶盛放溶液,胶头滴管定容,所以不用漏斗,答案选C;
(2)配制480 mL 0.2 mol/L NaOH溶液,应选择500mL的容量瓶,所以需要称量氢氧化钠的质量是0.5L×0.2mol/L×40g/mol=4.0g;
(3)氢氧化钠的物质的量和氢氧根离子的数目都与溶液的体积有关,而溶液的浓度与密度是溶液固有的属性,不随溶液的体积变化而变化,所以答案选BD;
(4)①氢氧化钠溶于水放热,未经冷却直接将溶液移入容量瓶,则会使溶液的体积偏小,氢氧化钠溶液的浓度偏高;
②在配制的过程中,需直接滴加蒸馏水,所以容量瓶内有少量的蒸馏水对实验的结果无影响;
③定容时俯视刻度线,使所配溶液的体积偏小,溶液的浓度偏高;
④未洗涤烧杯、玻璃棒,会使溶质的物质的量减少,所配溶液的物质的量浓度偏低。
考点:考查溶液的配制与计算


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:单选题
化学与人类生活、社会可持续发展密切相关,下列措施不利于节能减排、保护环境的是
| A.加快化石燃料的开采与使用 | B.研发易降解的生物农药 |
| C.推广使用节能环保材料 | D.应用高效洁净的能源转换技术 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
8分)准确称取12 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:
请填空回答:
(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=4.6,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各成分的质量分数:Al2O3为______________, SiO2为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液, 应称取NaOH的质量 g;
(2)容量瓶上标有 ;且使用前第一步操作: ;
(3)溶液注入容量瓶前需冷却到室温,这是因为_____________________________;
(4)定容时的操作 ;
(5)下列配制的溶液浓度偏低的是 ;
| A.称量NaOH时,砝码错放在左盘 |
| B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面 |
| C.定容时俯视刻度线 |
| D.配制前,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 +16HCl(浓) 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
(1)用单线桥法标出电子转移的方向和数目。
(2)该反应中的氧化剂与还原剂物质的量之比是 。
(3)KMnO4的氧化性比Cl2的氧化性 (选填“强”或“弱”)。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为 L。
(5)某同学欲用KMnO4固体配制100 mL0.5mol.L-1的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、 、 。
②应用托盘天平称取KMnO4固体 g。
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号) 。
| A.加水定容时俯视刻度线 |
| B.容量瓶内壁附有水珠而未干燥处理 |
| C.颠倒摇匀后发现凹液面低于刻度线又加水补上 |
| D.在溶解过程中有少量液体溅出烧杯外 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(8分)实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL。
(1)配制溶液时,一般可以分为以下几个步骤:
①称量②计算③溶解④摇匀⑤移液⑥洗涤⑦定容⑧冷却⑨摇动
其正确的操作顺序为____________________(填序号)。本实验必须用到的仪器有托盘
天平、药匙、玻璃棒、烧杯、_______、 。
(2)某同学欲称量NaOH的质量,先用托盘天平称量烧杯的质量,托盘天平平衡后的状
态如图所示。烧杯的实际质量为________g,要完成本实验该同学应称量________g NaOH。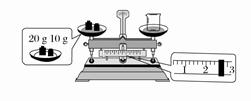
(3)使用容量瓶前必须进行的一步操作是 。
(4)配制过程中,下列操作会引起所配溶液浓度偏高的是
| A.转移溶液时,有少量溶液洒到容量瓶外面 |
| B.定容时俯视刻度线 |
| C.未冷却至室温就将溶液移入容量瓶中并定容 |
| D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)把18.0mol·L-1的浓硫酸稀释成2.00mol·L-1的稀硫酸100ml,实验操作如下:
| A.将配好的稀硫酸倒入试剂瓶中,贴好标签; |
| B.盖好容量瓶塞,反复颠倒,摇匀; |
| C.用量筒量取ml的18.0mol·L-1的浓硫酸; |
| D.将沿烧杯内壁慢慢注入盛有少量的烧杯中; |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)下面是用98%的浓H2SO4(ρ=1.84 g/cm3)配制成0.5 mol/L的稀H2SO4 500 mL的操作,请按要求填空:
①所需浓H2SO4的体积为________。
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________ mL量筒最好。
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的烧杯里,并不断搅拌,目的是_______ 。
④加水至液面接近刻度线1-2cm时,改用________加水,使溶液的凹液面正好跟刻度线相平。
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①定容时观察液面俯视:________;②NaOH颗粒表面部分变质:________。
(3)Fe(OH)3胶体的制备方法为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com