
(12分)已知298.2K时,![]() (C2H5OH,液)= -1366.8 kJ?mol-1,水和乙醇的摩尔蒸发焓
(C2H5OH,液)= -1366.8 kJ?mol-1,水和乙醇的摩尔蒸发焓![]() /( kJ?mol-1) 分别为44.01和42.6,C2H4(g), H2O(g)和 CO2(g)的
/( kJ?mol-1) 分别为44.01和42.6,C2H4(g), H2O(g)和 CO2(g)的![]() /( kJ?mol-1) 分别为52.26、-241.8及-393.5,求
/( kJ?mol-1) 分别为52.26、-241.8及-393.5,求
7-1 同温度下,分子式为CnH2n的物质的![]() 与
与![]() 之间的关系式;
之间的关系式;
7-2 求298.2K时C2H4(g) ![]()
7-3 298.2K时C2H5OH(气)的 ![]() 和
和![]()
7-4 298.2K时C2H4(g) + H2O(g) → C2H5OH(g)的![]()
7-1 CnH2n生成反应与燃烧反应化学计量方程式的关系如下:
 nC(石墨)+n H2(g)+
nC(石墨)+n H2(g)+![]() n O2(g)
n O2(g) ![]() nCO2(g)+nH2O(l)
nCO2(g)+nH2O(l)
(1) (2)
CnH2n+![]() n O2(g)
n O2(g)
反应(1)为CnH2n 的生成反应,故 ![]() =
=![]() (CnH2n)
(CnH2n)
反应(2)为CnH2n 的燃烧反应,故 ![]() =
=![]() (CnH2n)
(CnH2n)
反应(3)为nCO2(g) 和nH2O(l)生成反应,故
![]() = n
= n![]() (CO2,g) + n
(CO2,g) + n![]() (H2O,l)
(H2O,l)
又 ![]() =
=![]() +
+![]()
所以 ![]() (CnH2n) +
(CnH2n) + ![]() (CnH2n) = n
(CnH2n) = n![]() (CO2,g) + n
(CO2,g) + n![]() (H2O,l) (4分)
(H2O,l) (4分)
7-2 C2H4(g) ![]() = 2
= 2![]() (CO2,g) + 2
(CO2,g) + 2![]() (H2O,l) -
(H2O,l) -![]() (C2H4, g)
(C2H4, g)
= 2×(-393.5)+ 2×(-241.8-44.01)-52.26
= -1411(kJ.mol-1) (2分)
7-3 先求C2H5OH(l)的![]() ,由C2H5OH(l) 的燃烧反应
,由C2H5OH(l) 的燃烧反应
C2H5OH(l) + 3O2(g)→ 2CO2(g)+3H2O(l)
因为 ![]() =
=![]() (C2H5OH,l )
(C2H5OH,l )
= 2![]() (CO2,g) + 3
(CO2,g) + 3![]() (H2O,l) -
(H2O,l) -![]() ( C2H5OH,l)
( C2H5OH,l)
所以 ![]() ( C2H5OH,l)
( C2H5OH,l)
= 2![]() (CO2,g) + 3
(CO2,g) + 3![]() (H2O,l) -
(H2O,l) -![]() (C2H5OH,l)
(C2H5OH,l)
= 2 × (-393.5)+ 3 × (-241.8-44.01) +1366.8
= -277.6 kJ.mol-1
![]() (C2H5OH,g) =
(C2H5OH,g) = ![]() (C2H5OH,l) +
(C2H5OH,l) +![]() (C2H5OH)
(C2H5OH)
= -277.6 + 42.6 = -235.0 kJ.mol-1
![]() (C2H5OH,g) =
(C2H5OH,g) =![]() (C2H5OH,l )-
(C2H5OH,l )-![]() (C2H5OH)
(C2H5OH)
= -1366.8-42.6 = -1409.4 kJ.mol-1 (4分)
7-4 ![]() =
=![]() (C2H5OH,g) -
(C2H5OH,g) -![]() (H2O,g)-
(H2O,g)-![]() ( C2H4,g)
( C2H4,g)
= -235.0 +241.8-52.26 = -45.46 kJ.mol-1 (2分)


科目:高中化学 来源:2015届重庆市高二上学期期中考试化学试卷(解析版) 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下溶解平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)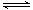 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
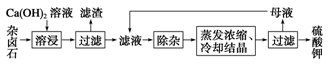
(1)滤渣主要成分有________和CaSO4以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。由图可得,随着温度升高,
① ,
② ,

③溶浸出的K+的平衡浓度增大。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32-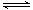 CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=
。
CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com