
分析 100克稀硫酸溶液中加入7.8克铝镁合金,待合金全部溶解完毕,称得反应后的溶液质量为107克,则氢气为100g+7.8g-107g=0.8g,气体的物质的量为$\frac{0.8g}{2g/mol}$=0.4mol,设Mg为xmol,Al为ymol,由质量守恒、电子守恒可知,
$\left\{\begin{array}{l}{24x+27y=7.8}\\{2x+3y=0.4×2}\end{array}\right.$,以此来解答.
解答 解:100克稀硫酸溶液中加入7.8克铝镁合金,待合金全部溶解完毕,称得反应后的溶液质量为107克,则氢气为100g+7.8g-107g=0.8g,气体的物质的量为$\frac{0.8g}{2g/mol}$=0.4mol,设Mg为xmol,Al为ymol,由质量守恒、电子守恒可知,
$\left\{\begin{array}{l}{24x+27y=7.8}\\{2x+3y=0.4×2}\end{array}\right.$,
解得x=0.1mol,y=0.2mol,
合金中Mg的质量为0.1mol×24g/mol=2.4g,
答:合金中镁的质量为2.4g.
点评 本题考查氧化还原反应的计算,为高频考点,把握质量守恒定律计算氢气的质量、电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| C. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| D. | 氯化铁溶液可用制作印刷电路板:Cu+Fe3+═Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发 | B. | 蒸馏 | C. | 过滤 | D. | 萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
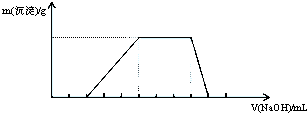
| A. | H+、Al3+、AlO2-、SO42- | B. | H+、NH4+、Al3+、NO3- | ||
| C. | H+、NH4+、Mg2+、Cl- | D. | NH4+、Al3+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽马鞍山二中高一10月阶段测化学卷(解析版) 题型:计算题
在标准状况下,由20gCO和CO2组成的混合气体,其体积为13.44 L,则此混合物中CO和CO2的质量分别是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com