
| A. | N2H4是氧化产物 | B. | N2H4中存在极性键和非极性键 | ||
| C. | 配平后,OH-的化学计量数为2 | D. | 生成3.2gN2H4转移0.lmol电子 |
分析 该反应中,N元素化合价由-3价变为-2价,Cl元素化合价由+1价变为-1价,转移电子数为2,所以方程式为CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O,据此分析解答.
解答 解:该反应中,N元素化合价由-3价变为-2价,Cl元素化合价由+1价变为-1价,转移电子数为2,所以方程式为CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O,
A.N元素化合价由-3价变为-2价,所以尿素是还原剂,肼是氧化产物,故A正确;
B.肼分子中N-H原子之间存在极性键,N-N原子之间存在非极性键,故B正确;
C.根据以上分析知,配平后,氢氧根离子的化学计量数是2,故C正确;
D.3.2g肼的物质的量是0.1mol,生成3.2 g N2H4转移电子物质的量=0.1 mol×[1-(-1)]=0.2mol,故D错误;
故选D.
点评 本题考查化学键、方程式的配平、物质的量的计算、氧化剂和氧化产物判断等知识点,侧重考查基本概念、基本计算,明确元素化合价变化即可解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
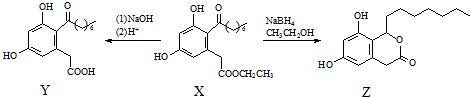
| A. | X、Y和Z中均不含手性碳原子 | |
| B. | Y能发生氧化、还原、取代反应 | |
| C. | 一定条件下,1 mol X最多能与5 mol H2发生加成反应 | |
| D. | 1 mol Z最多可与含3 mol NaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向10mL0.1mol/LFeCl2溶液中缓缓通入标准状况下11.2mLCl2 | |
| B. | 向AlC13溶液中滴加Na2S溶液 | |
| C. | 向含有Na+、Fe2+、Cl-、SO42-的溶液中通入NO2 | |
| D. | 向5mL0.1mol/LNaOH溶液中,逐滴加入1mL0.1mol/LAlCl3溶液,边滴加边振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的核外电子数为86 | B. | 中子数为86 | ||
| C. | Rn元素的相对原子量为222 | D. | 质子数为136 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
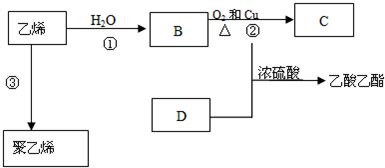
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
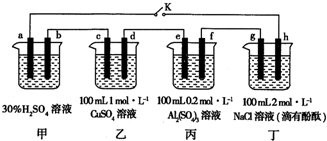
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 | B. | MgCl2 | C. | KCl | D. | FeCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com