
【题目】常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A.9.0
B.9.5
C.1 0.5
D.1 1.0
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】5.76g部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO),经如下处理,下列说法正确的是( ) 
A.V=224
B.样品中Fe的质量为2.14 g
C.未氧化前Fe元素的质量分数约为41.2%
D.样品中CuO的质量为3.52 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍.电镀厂产生的镀铜废水中往往含有一定量的Cr2O72﹣ , 处理该废水常用的流程如图1所示:
Na2S2O3在此过程中表现性.若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为价,反应的离子方程式为 .
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车.其反应原理如下,请配平该反应方程式:CrO3+CH3CH2OH+H2SO4﹣CH3CHO+Cr2(SO4)3+H2O
(3)已知存在平衡:2CrO42﹣+2H+Cr2O72﹣+H2O.向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为(任意写出其中一种即可).此时溶液中c(Pb2+):c(Ba2+)= .
已知Ksp(BaCrO4)=1.25×10﹣10;Ksp(PbCrO4)=2.75×10﹣13
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7 , 制备装置如图2所示(阳离子交换膜只允许阳离子透过).通电后阳极的电极反应式为 . 请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式.
①甲苯→TNT
②乙醛与银氨溶液反应的离子方程式
③2﹣溴丙烷→丙烯
④乙烯→乙醇 .
⑤苯酚钠溶液中通入二氧化碳气体的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石中的碳化钙和水能完全反应:CaC2+2H2O═C2H2↑+Ca(OH)2使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量.
(1)若用下列仪器和导管组装实验装置:
序号 | 1 | 2 | 3 | 4 | 5 | 6 |
导管及仪器 |
|
|
|
|
|
|
每个橡皮塞上都打了两个孔 | ||||||
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是:接接接接接 .
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞.
②检查装置的气密性.
③在仪器6和5中注入适量水.
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计).
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞.
正确的操作顺序(用操作编号填写)是 .
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有杂质.
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是 %.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层.外层的优氯净 Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去;优氯净中氯元素的化合价为;无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另一固体.请写出无水亚硫酸钠受热分解的反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS)制备钼酸钠晶体的部分流程如图1: 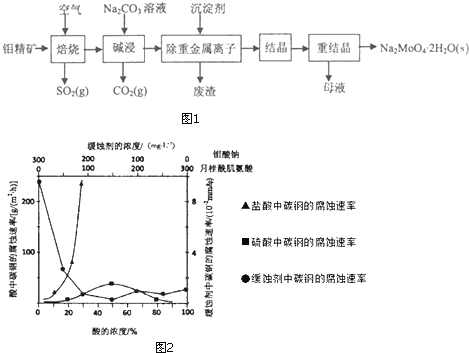
(1)写出“碱浸”反应的离子方程式;
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42﹣ . 当BaMoO4开始沉淀时,SO42﹣的去除率是;[已知:碱浸液中c(MoO42﹣)=0.40molL﹣1 , c(SO42﹣)=0.04molL﹣1 , Ksp(BaSO4)=1.1×10﹣10、Ksp(BaMoO4)=4.0×10﹣8 , 加入Ba(OH)2固体引起的溶液体积变化可忽略]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是;
(4)如图2是碳钢在3种不同介质中的腐蚀速率实验结果:
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是;
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4﹣Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2 . NaNO2的作用是;
③若缓释剂钼酸钠﹣月桂酸肌氨酸总浓度为300mgL﹣1 , 则缓蚀效果最好时钼酸钠的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种重要的有机化工原料有机物X,下面是以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去),Y是一种功能高分子材料. 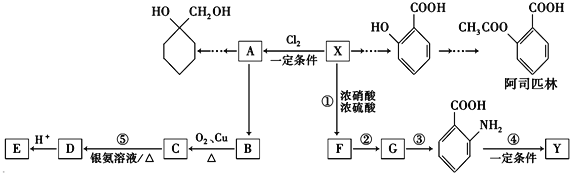
已知:
①X为芳香烃,其相对分子质量为92
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基: ![]() ③
③ ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为;
(2)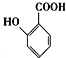 中官能团名称为;
中官能团名称为;
(3)反应③的反应类型是;已知A为一氯代物,则E的结构简式是;
(4)反应④的化学方程式为;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有种:
①含有苯环;
②既不能发生水解反应,也不能发生银镜反应;
③1mol该有机物能与2molNaHCO3完全反应.
(6)参照上述合成路线,结合所学知识,设计一条以A为原料制备  的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH ![]() H2C=CH2
H2C=CH2![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com