
| �¶ȣ�K�� CO2ת���ʣ�%�� n��H2��/n��CO2�� | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
���� ��1�����û�ѧƽ�ⳣ��������ת���̶ȣ�ƽ�ⳣ������ת���̶ȴ�
��2�����ɱ����е����ݿ�֪���¶�Խ�ߣ�CO2ת���ʼ�С��ƽ�������ƶ���
�������̼�ȴ�ʹ��Ӧ�����ƶ��ij̶����������������Ҵ���
��� �⣺��1����Ӧ�ڵ�K����������еij̶ȴ���Ӧ���ת���̶ȸߣ��ʴ�Ϊ���ڣ�
��2�����ɱ������ݿ��Կ������¶�Խ�ߣ�CO2ת���ʣ�˵��ƽ�������ƶ�����KֵԽС���ʴ�Ϊ����С��
�ڸ��ݱ����֪��������������ʱ�������̼��[n��H2��/n��CO2��]��CO2ת��������˵��ƽ��������Ӧ�����ƶ��������ڵĺϳɣ��ʴ�Ϊ��������
���� ���⿼��ƽ�ⳣ�����壬Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬ע����ջ�ѧƽ�ⳣ���ĸ��Ӱ�����ء�Ӱ�컯ѧƽ������أ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
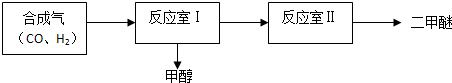
| ��� | �¶ȣ���C�� | ��ʼŨ�ȣ�mol•L-1�� | ƽ��Ũ�ȣ�mol•L-1�� | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | ||
| �� | T | 1 | 3 | 0 | 0.2 | 1.4 | 0.8 |
| �� | T | 1.5 | 4.6 | 0.1 | b1 | b2 | b3 |
| �� | T+30 | 1 | 3 | 0 | 0.25 | 1.5 | 0.75 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4.2 g CO | B�� | 6.6 g CO2 | C�� | 8 g SO2 | D�� | 9.8 g H2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������˲����㣬�Ҿ���һ����Σ���ԣ�Ŀǰ��������������Խ��������Ʒ���������ش�
�������˲����㣬�Ҿ���һ����Σ���ԣ�Ŀǰ��������������Խ��������Ʒ���������ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

| ʵ����� | 1 | 2 | 3 | 4 |
| ����NaOH��Һ�������mL�� | 20.05 | 20.00 | 18.80 | 19.95 |
| ��ƿ����Һ | �ζ�������Һ | ѡ��ָʾ�� | ѡ�õζ��� | |
| A | �� | �� | ʯ�� | ���ң� |
| B | �� | �� | ���� | ���ף� |
| C | �� | �� | ��̪ | ���ף� |
| D | �� | �� | ��̪ | ���ң� |
| ����Ũ�ȣ�mol•L-1�� | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaCO3$\frac{\underline{\;����\;}}{\;}$CaO+CO2�� | B�� | Na2O+H2O=2NaOH | ||
| C�� | Na2CO3+2HCl=2NaCl+H2O+CO2�� | D�� | 4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$4NO2��+O2��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al2��SO4��3�T2Al3++3SO42- | B�� | FeCl2�TFe2++3Cl- | ||
| C�� | H2SO4�TH2++SO42- | D�� | Ca��OH��2�TCa2++2��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
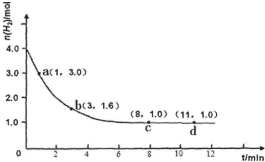 ��ҵ�ϳɰ��ķ�ӦΪ��N2��g��+3H2��g��?2NH3��g����H��0ijʵ�齫3.0mol N2��g����4.0mol H2��g�������ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯��ͼ��ʾ��
��ҵ�ϳɰ��ķ�ӦΪ��N2��g��+3H2��g��?2NH3��g����H��0ijʵ�齫3.0mol N2��g����4.0mol H2��g�������ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯��ͼ��ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com