
| A. | Z为0.3 mol/L | B. | Y2为0.1 mol/L | C. | X2为0.2 mol/L | D. | Z为0.35mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.1 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.2 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.3 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.1<c(Y2)<0.3,0<c(Z)<0.4,
综合以上分析可知B正确,
故选B.
点评 本题考查了化学平衡的建立,难度中等,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如图转化关系:(部分反应物,产物略去).下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如图转化关系:(部分反应物,产物略去).下列有关物质的推断正确的是( )| A. | 若甲为HNO3,则丁可能是Fe | B. | 若甲为AlCl3,则丁可能是氨水 | ||
| C. | 若甲为焦炭,则丁可能是SiO2 | D. | 若甲为NaOH 溶液,则丁可能是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


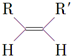 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO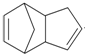 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$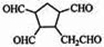 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B能发生消去、氧化、取代、缩聚等反应 | |
| C. | 1molM与足量烧碱溶液反应,可消耗2nmolNaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了提取电子垃圾中有用的金属,可将其进行焚烧 | |
| B. | 模型一般可分为物体模型和思维模型 | |
| C. | 某同学研究SO2性质的程序是分类(预测SO2的化学性质)→观察(得出SO2的物理性质)→实验→比较并得出结论 | |
| D. | 科学实验能解决化学学科的所有问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com