
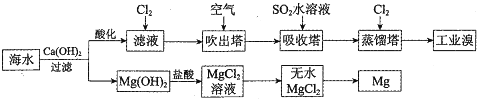
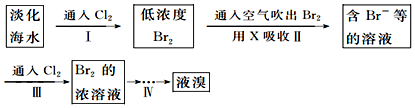
 _.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应
_.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应分析 (一)(1)依据流程分析,海水中加入氢氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤后在沉淀中加入盐酸溶解,得到氯化镁溶液,通过浓缩蒸发,冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到无水氯化镁,电解熔融氯化镁得到金属镁;海水浓缩晒盐得到卤水中通入氧化剂氯气氧化溴离子得到溴单质,2Br-+C12=Br2+2Cl-,吹入热的空气用二氧化硫吸收富集溴SO2+Br2+2H2O=4H++2Br-+SO42-,通入氯气发生氧化还原反应生成单质溴.
A.氢氧化钠能和溴反应,而被除去;
B.电解熔融MgCl2生成镁和氯气;
C.先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的;
D.依据离子方程式计算得到需要的氯气体积;
(二)(2)氯气是氯原子间形成一对共用电子对;过程Ⅰ是氯气氧化溴离子生成溴单质,海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,H++OH-=H2O:K=$\frac{1}{c({H}^{+})c(O{H}^{-})}$;根据氯气的溶解平衡结合化学平衡移动原理来解释;
(3)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据电子守恒配平方程式;
(4)溴酸根离子具有氧化性,能将氯离子氧化;
解答 解:(一)(1)A.工业溴中含少量Cl2,用NaOH溶液除去,溴和氢氧化钠反应生成溴化钠、次溴酸钠和水,反应的化学方程式为:Br2+2NaOH═NaBr+NaBrO+H2O,溴被除去,故A错误;
B.从MgCl2溶液中得到MgCl2固体,电解熔融氯化镁得到金属镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,故B正确;
C.海水提取溴一般用氯气置换溴离子转化为溴单质,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的,故C正确;
D.若提取1 mol Br2,依据2Br-+Cl2=Br2+2Cl-,提取粗溴消耗氯气物质的量为:1mol,得到纯溴需氯气物质的量为:1mol,所以在标准状况下体积为V=nVm=2mol×224.4L/mol=44.8 L,温度压强不知不能计算气体体积,故D错误;
故选BC,
故答案为:BC;
(二)(2)氯气是氯原子间形成一对共用电子对,氯气电子式为: ,过程Ⅰ是氯气氧化溴离子生成溴单质,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-; 海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,H++OH-=H2O:K=$\frac{1}{c({H}^{+})c(O{H}^{-})}$=1014,氯气的溶解平衡为:Cl2+H2O=H++Cl-+HClO,若增大c(H+),平衡逆向移动,会抑制Cl2与水的反应,提高Cl2的利用率,
,过程Ⅰ是氯气氧化溴离子生成溴单质,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-; 海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,H++OH-=H2O:K=$\frac{1}{c({H}^{+})c(O{H}^{-})}$=1014,氯气的溶解平衡为:Cl2+H2O=H++Cl-+HClO,若增大c(H+),平衡逆向移动,会抑制Cl2与水的反应,提高Cl2的利用率,
故答案为: ; Cl2+2Br-=Br2+2Cl-; 1014 ;Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应;
; Cl2+2Br-=Br2+2Cl-; 1014 ;Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应;
(3)氧化还原反应中,Br的化合价升高值为5,氧化还原反应中的价态律,所以所的产物是-1价的溴离子,Br元素化合价降低值为1,根据电子守恒,所以溴酸钾的前边系数是1,产物还有5mol的NaBr,溴单质系数是3,根据钠元素守恒,碳酸钠的系数是3,故答案为:3;3;1;3;5NaBr;
(4)盐酸有还原性,溴酸根离子具有氧化性,盐酸可以和与溴酸根反应,导致溴单质的生成量减少,
故答案为:盐酸有还原性,与溴酸根反应;
点评 本题考查了海水资源的综合应用,以卤族元素的性质考查为载体,注重氧化还原反应的考查,为高频考点,涉及物质的分离提纯等知识,侧重于化学与生活的综合运用,培养了学生运用知识分析问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 最终得到沉淀的质量大于$\frac{37m}{28}$g | |
| B. | 该饱和溶液质量百分比浓度为$\frac{s}{100+s}$% | |
| C. | 最终所得溶液c(OH-)不变 | |
| D. | 该饱和溶液中溶质物质的量浓度为$\frac{1000ρs}{74(100+s)}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
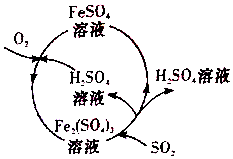 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )| A. | 该过程中可得到化工产品H2SO4 | |
| B. | 该工艺流程是除去煤燃烧时产生的SO2 | |
| C. | 该过程中化合价发生改变的元素为Fe和S | |
| D. | 图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O═2FeSO4+2H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.| 温度/K | 反应① | 反应② | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,1 L 0.50 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH+4物质的量不同 | |
| B. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| D. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com