
【题目】下列离子方程式正确的是( )
A. 钠与水反应:Na+2H2O= Na+ +2OH- + H2↑
B. 硅酸钠溶液与醋酸溶液混合:SiO32- + 2H+= H2SiO3↓
C. 0.01mol/L NH4Al(SO4)2 溶液与0.02mol/L Ba(OH)2 溶液等体积混合:
NH4+ +Al3 + +2SO42- +2Ba2+ +4OH- = 2BaSO4 ↓+Al(OH)3 ↓+ NH3·H2O
D. 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ = Fe3+ +3NO2↑+3H2O
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( ) 
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.b点有BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属与足量稀硝酸充分反应,无气体放出,再向该溶液中加入过量NaOH溶液,加热,收集到标况下气体0.224升,整个过程转移电子的物质的量为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:
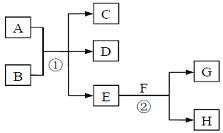
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是____。
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间。则反应①的离子方程式是__________。
(3)若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是_____________。
(4)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生。在加热条件下,当A过量时,反应①的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C18H26O5 , 1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
A.C14H18O5
B.C14H16O4
C.C16H22O5
D.C16H20O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4H2O+NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是;
(2)实验二:制取水合肼(实验装置如图所示)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充 分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分.(已知:N2H4H2O+2NaClO=N2↑+3H2O+2NaCl)
分液漏斗中的溶液是(填标号A或B);
A.NaOH和NaClO混合溶液B.CO (NH2) 2溶液
选择的理由是;
(3)实验三:测定馏分中肼含量
水合肼具有还原性,可以生成氮气.测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液.
b.移取25.00mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右.记录消耗碘的标准液的体积.
d.进一步操作与数据处理
①水合肼与碘溶液反应的化学方程式;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是;
②滴定时,碘的标准溶液盛放在滴定管中(选填:“酸式”或“碱式”);若三次滴定消耗碘的标准溶液的平均体积为18.00mL,则馏分中水合肼(N2H4H2O)的质量分数为(保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. H2的摩尔质量是2g/mol
B. 物质的量的符号是mol
C. 常温常压下Cl2的摩尔体积是22.4L/mol
D. 物质的摩尔质量的数值等于其相对原子质量或相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com